- +1
愛吃辣的你,其實在找虐?
原創 一一 神經現實 來自專輯深度 | Deep-diving

如此,一個被我們稱為“我”的小人物,通過燙、辣、涼、冷、疼感受著此刻的世界。很難想象,這些感受能力消失了會是什么樣。但我們確實因為這些感受的異常而不時苦惱:抓心撓肝般磨人的疼痛,越抓越劇烈的持續瘙癢,異常的冷和熱,甚至還有癌癥痛和神經痛。
人類一直試圖探究意識的源起,也一直試圖掌控我們的軀體。隨著解剖學的進步,我們知道了神經元在感受傳導中的神奇作用。但每時每刻感受著這個世界的神經元,如何區分酸甜苦辣咸、寒熱溫涼?決定神經元功能差異的,又會是神經細胞中的什么呢?
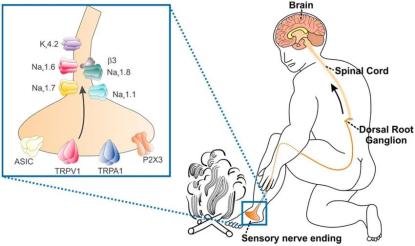
在很長一段時間內,科學家們猜測,神經細胞對不同刺激的不同響應,很可能依賴于細胞膜上的離子通道受體[1],[2]。離子通道受體,就如同房屋上的門窗,它的開放與關閉影響著細胞內外離子的進出,而對陰陽離子不同的選擇性,又會影響細胞膜電位的變化。正常的細胞膜維持著外正內負的電位差,如果大量陽離子流入或者陰離子流出,都將導致細胞膜的去極化(靜息電位向膜內負值減小的方向變化),達到一定水平,還將誘發動作電位(又稱神經沖動),其可在神經細胞間不衰減地傳導,如同電流在無阻抗電線中的傳導一般,最終可到達大腦皮層,產生不同的感受。
-
Pain-Causing Venom Peptides: Insights into Sensory Neuron Pharmacology
https://www.mdpi.com/2072-6651/10/1/15/htm#
猜想變現實是極大的挑戰,尤其是在我們還難以想象蛋白質如何對應對寒熱溫涼等物理化學刺激時,而實現這一偉大突破的是美國生理學家大衛·朱利葉斯(David Julius)。
上世紀九十年代,擅長受體克隆的朱利葉斯,開始對軀體感受與疼痛的分子機制產生興趣。以辣椒為切入點,在經歷重重困難后,他最終于1997年成功克隆出辣椒素特異性受體——香草素受體1型(TRPV1),并意外發現該受體可以被43℃以上的物理高溫激活[3]。這一偉大的發現,首次呈現了離子通道受體在物理化學刺激間的信號轉導作用,即辣椒素等天然化學物質刺激與溫度等物理刺激,可通過細胞膜上TRPV1通道統一轉化為電信號,從分子層面為我們展現了軀體感受認知的最基礎的來源,更新了我們對軀體感受的認知。
此后的二十多年,朱利葉斯以TRPV1為起點,又相繼發現了多種與軀體感受相關的TRP家族的通道蛋白。與此同時,他與同事程亦凡的實驗室合作,解析了包括TRPV1在內的多種TRP蛋白的三維結構,并綜合運用基因敲除等生理手段,試圖回答這些神奇蛋白的結構與功能關系,為靶向藥物開發提供理論基礎。
如此開創性與系統性的研究工作,也使他陸續獲得2020年度的生命科學突破獎與科維理神經科學獎(Kavli Prize)。
在不久前揭曉的科維理神經科學獎中,評審委員會主席克里斯汀·沃爾霍夫德(Kristine B. Walhovd)表示:“朱利葉斯和阿德姆·帕塔博蒂安(Ardem Patapoutian)的獨立發現正在徹底改變我們對于感覺探測的認知,并將對解決全球健康和疾病問題產生深遠影響。”
2020科維理神經科學獎
大衛·朱利葉斯
David Julius

他于2004年當選為美國國家科學院院士,2005年當選為美國藝術與科學學院院士,并因在辣椒素和溫度方面的TRPV1受體研究工作,成為匈牙利科學院的名譽會員。最近他獲得的其他獎項包括2017年加拿大蓋爾德納國際獎、2019年羅森斯蒂爾基礎醫學獎和2020年生命科學突破獎。

阿德姆·帕塔博蒂安
Ardem Patapoutian

他于2000年加入斯克里普斯研究所,現任神經科學教授。他領導了涉及感知溫度和觸覺,以及本體感覺和血壓的調節的離子通道和受體的識別工作。他最近獲得的榮譽包括2017年哥倫比亞大學的阿爾登·斯賓塞獎(與David Ginty分享)和2019年羅森斯蒂爾基礎醫學研究杰出工作獎(與David Julius分享)。他于2014年被任命為霍華德·休斯醫學研究所的研究員,并于2017年當選為美國國家科學院院士,于2020年當選為美國藝術與科學院院士。

在剛發現辣椒素受體TRPV1時,人們對能將化學和物理信號轉變為電信號的蛋白受體感到相當興奮。但與此同時,人們又驚訝地發現辣不是一種味覺,而是一種痛覺。
究其原因,TRPV1受體特異性表達于傷害性感受神經元(特異性識別傷害性刺激的傳入神經元),且在身體多種組織器官內廣泛分布。當有辣椒或者高溫刺激時,TRPV1受體立即被激活,產生電信號,信號沿傷害性傳入神經系統上傳至大腦。又因為大腦對傷害性傳入神經信號的解讀統一為“疼痛”的刺激感,所以辣覺被科學地定義為痛覺[3](當然,辣痛與普通疼痛存在區別,源于它的熱感受屬性)。這就不難解釋,為什么除了嘴巴,我們的眼睛和皮膚也會有辣痛感。

破壞辣椒素與TRPV1受體間的結合,如飲用油脂高的食物或飲料(牛奶、豆奶、奶油冰激凌等),從而溶解結合于受體上的辣椒素。
干擾大腦對辣的感受過程,例如蔗糖和香草素就有不錯的解辣效果。香草素解辣的原因比較復雜,而蔗糖解辣一方面是因為甜與辣的刺激作用于口腔中不同的受體細胞,受體細胞之間的相互作用干擾大腦意識的產生,另一方面,大腦在接受甜刺激后會釋放鎮痛物質,進而緩解辣的痛感。
還有一個有趣的研究發現,捏緊鼻孔能抑制50%的辣感受,原因是鼻孔關閉,舌頭表面溫度會隨之降低,而溫度的降低又會減少TRPV1激活的可能。(下次辣到崩潰,也許你可以第一時間試試捏緊鼻子[4]?)
除了餐桌上的調味劑,人們還一直將辣椒當作鎮痛劑。但直到TRPV1發現之后,辣椒的鎮痛奧秘才浮出水面:TRPV1的離子通道性質在被持續激活時,陽離子將不斷地涌入細胞,而過多的鈣離子可產生細胞毒性,細胞出于自身保護便會反饋性地關閉TRPV1通道,并使傷害性感受神經元對辣椒素甚至其他傷害性刺激脫敏,減少痛覺信號的產生,由此抑制疼痛感受。
抓住TRPV1受體與鎮痛的關系后,科學家們便將其視作治療多種慢性疼痛的新的重要藥物靶標。大型制藥公司紛紛入局,通過模擬和提升辣椒素對于TRPV1通道的激活作用,或者直接抑制通道功能,來阻斷大腦對疼痛的感知,寄希望于研發出新的高效的止痛藥,以補充已有藥物在治療上的局限與強風險(阿片類藥物存在成癮性問題,一些抗炎止痛藥具有肝臟和心血管損傷風險)。目前,已有十幾種相關藥物進行到各階段的臨床試驗,比如生物制藥公司Centrexion Therapeutics推出的超純合成辣椒素(反式異構體)制劑CNTX-4975[5]。該制劑通過一個特殊注射裝置導向骨關節注射,治療膝關節中度至重度疼痛,目前已進入三期臨床試驗。
“火辣”開啟溫度覺探索的大門
讓我們感到痛的同時,辣椒又為什么會讓我們覺得熱呢?
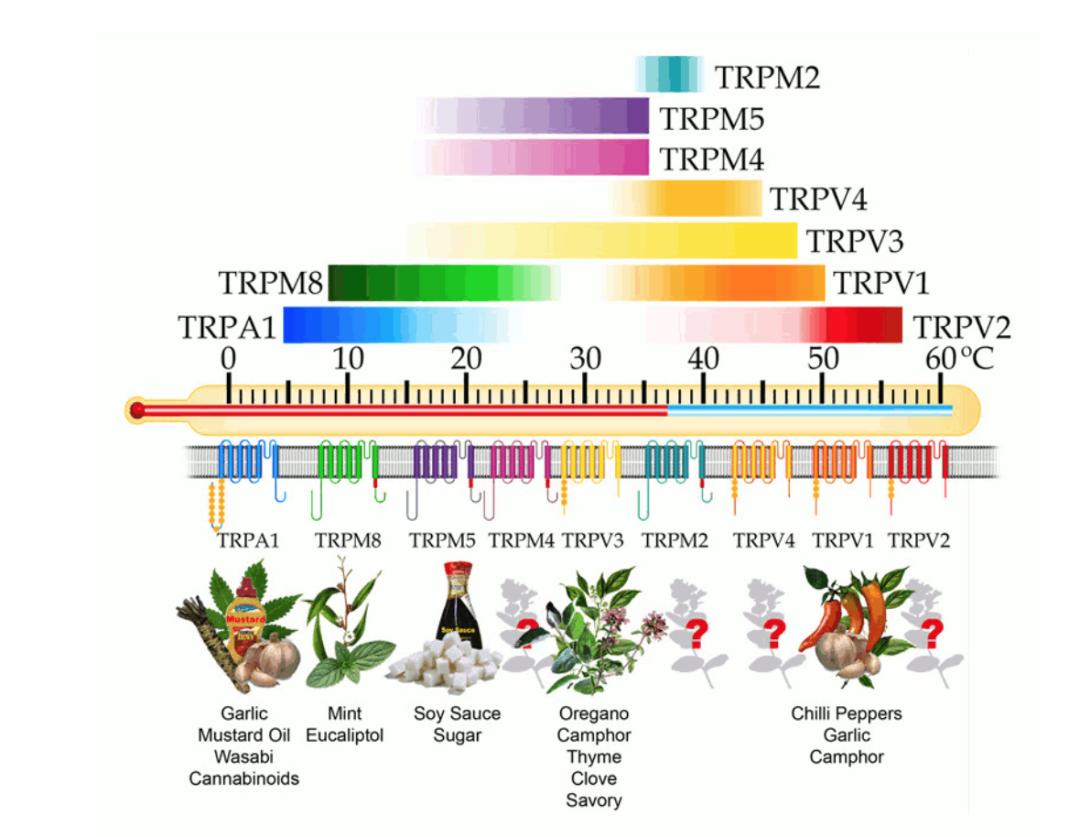
如前所述,TRPV1受體在被辣椒素激活時,還可被43℃以上的物理高溫激活。在TRPV1之后,大衛·朱利葉斯和其他科學家團隊又相繼發現,多種與TRPV1相類似的離子通道蛋白(共屬于TRP蛋白家族)與溫度感受相關。例如,同樣獲得科維理神經科學獎的阿德姆·帕塔博蒂安(Ardem Patapoutian)的團隊,在2002年通過薄荷醇分子(薄荷的主要成分),確認了一類薄荷醇敏感離子通道TRPM8,該通道能被8℃~28℃的無害低溫激活[6]。2003年,該團隊又發現了可被芥末激活的冷覺感受通道——TRPA1,它能被超低溫(<17℃)激活[7]。
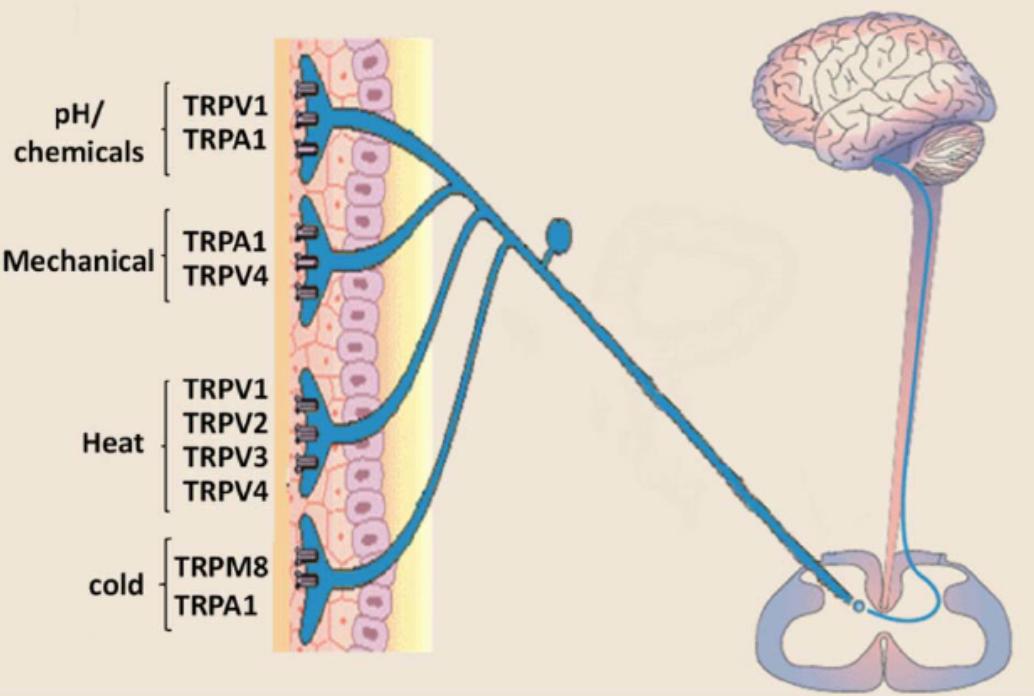
目前,我們已經可以從分子層面基本推斷寒熱溫涼感受的來源:初級感覺神經元表達多種與溫度感受相關的TRP通道亞型,例如,感受傷害性熱的TRPV1(≥42℃),TRPV2 (≥52℃)[8],TRPM3(≥40℃)[9];感受非傷害性熱的TRPV3 (≥31℃)[10],TRPV4(≥ 25℃)[11], TRPM2(≥35℃)[12],TRPM4/TRPM5(15-25℃)[13];感受非傷害性冷的TRPM8 (≤28℃);感受傷害性冷的TRPA1(≤17℃)以及感受溫度降低的TRPC5(25-37°C)[14]。當機體處于不同的溫度環境時,特異性的溫度敏感型離子通道將被激活產生電信號,經神經系統傳輸至大腦,產生特定的溫度感受[15]。
-
Structure–functional intimacies of transient receptor potential channels
DOI: https://doi.org/10.1017/S0033583509990072
有趣的是,感受寒熱溫涼的蛋白受體竟不是專司其職,反而“一心多用”,以至于造就了辣椒火熱、薄荷清涼的神奇體驗。那么問題來了,我們吃辣椒時感受到的熱,真的與物理溫度升高有關嗎?換言之,我們所說的熱性/易上火類物質“熱”在哪兒?
可以肯定的是,食用辣椒類物質的熱并非物理溫度改變的結果,而是感受上的結果。大家可能都有過這樣的感受:被辣到后對熱的感受更敏感了。這是因為可同時被辣椒素與物理高溫(≥42℃)激活的TRPV1通道,在被辣椒素激活后,對溫度感受的閾值降低,即不到42℃的體溫也能誘發傷害性“熱”感受;同時,辣椒素與溫度對TRPV1受體的雙激活,也大大增強了表達有該受體的感覺神經元的興奮性。因此我們的感受被“異常”放大,即使一口40℃的辣湯就有“噴火”感。
如果辣椒的熱感是大腦的“異常感知”,那我們擔心吃辣加劇口腔潰瘍的所謂“上火”又作何解釋?這取決于TRPV1受體在信號傳導中的性質。
由于TRPV1受體是在神經與非神經組織中都有表達的非選擇性陽離子通道,它的激活會介導大量鈣離子內流,產生電信號的同時,在非神經組織中,胞內增高的鈣離子濃度,還將介導多種神經肽的釋放,如P物質(SP)和降鈣素基因相關肽(CGRP)。SP可以引發血管舒張和血管通透性增加,導致水腫形成,還可以刺激肥大細胞釋放組胺等炎癥介質,誘導白細胞釋放蛋白酶和活性氧(ROS)。CGRP能放松動脈,也能調節皮膚血流量的增加),引起神經源性炎癥[16]。
所以“上火”與火無關,而是機體出于“自身防御”誘發的炎癥反應。雖然我們習慣視疼痛與炎癥為疾病,但疼痛與炎癥存在的初衷是保護機體遠離傷害,與炎癥相關聯的是免疫,紅腫處的炎癥就如一面標著“SOS”的小紅旗,大聲提醒免疫系統:“嘿,伙計,此處有破壞份子”。
除辣椒素外,乙醇、類胰蛋白酶、樹脂毒素、大蒜素、姜油、芥子油等也都能引發神經源性炎癥,它們正好源于我們常說的幾種“上火”食物:酒精、菠蘿、蒜頭、生姜……而更有趣的是,TRP家族中很多蛋白亞型,也正是這些“上火”物質的受體(參見圖二),比如冷覺受體TRPA1又稱為“芥末受體”,可被芥子油、大蒜素甚至吸煙時的煙霧激活。最近還有研究把TRPA1稱為“咳嗽的開關”:研究人員利用紙煙煙霧中含有的丙烯醛等物質進行試驗,發現無論老鼠還是志愿者,吸入這些物質后都會咳嗽。吸入量越大,咳嗽越厲害。但如果用藥物抑制體內的TRPA1受體,他們的咳嗽程度就會明顯減輕。目前這一發現已用于研發治療慢性咳嗽的藥物[17]。
TRP家族與光感受
從疼痛到溫度覺的解密,TRP家族快速地填充我們對感受的認知。讓我們將時間軸拉回20世紀60年代,當時的科學家們運用多種誘變方法處理果蠅,希望能在不同的誘變型中有新的科學發現,而TRP就是其中之一。
1969年,科曾斯(Cosens)和曼寧(Manning)發現一種有著異常趨光性和視網膜電位的突變果蠅品系[18],猜想該突變基因可能表達了一種光受體。1975年,隨著電生理技術的進步,威廉·帕克(William Pak)實驗室終于獲得該突變體與野生型果蠅在單個光感受細胞上的電位差異,以及突變體對光反應是瞬時的電位變化特征,于是首次將該突變體命名為瞬時受體電位(TRP)[19]。自此,TRP通道在光感受上的作用成了新的科學問題。
-
New Strategies to Develop Novel Pain Therapies: Addressing Thermoreceptors from Different Points of View
https://www.mdpi.com/1424-8247/5/1/16
2000年以后,隨著TRPV1和TRPA1受體研究的增多,最新發現TRPV1和TRPA1受體對紫外線有響應[20]。紫外線和藍光可產生單態氧,而單態氧又起到TRPA1和TRPV1激動劑的作用,增強其對光敏感性[21]。這一發現對于那些暴露于陽光下,有著異常疼痛與灼燒感的皮膚卟啉癥患者,以及在接受光動力療法治療的癌癥患者極其重要[20],[22]。
結語
至此,我們已從辣椒素受體的發現開始,逐步了解了離子通道受體在痛覺、溫度覺以及光感受中的神奇作用,見識到了TRP這個寶藏家族的多元技能。芥末蔥姜蒜、寒熱溫涼痛,電壓機械力,無不與其相關。
當然,TRP蛋白家族在生命活動中的功能并不局限于此,既不能認為所有的TRP通道都是感覺受體,也不能認為所有的感覺受體都是TRP通道[23]。在TRP家族之外,帕塔博蒂安發現的Piezo蛋白家族與軀體壓力感受間的關聯,也是一個極其宏大的科學問題,可從觸覺、聽覺、本體感受等維度解釋我們對這個世界的機械感知[24]。而這,就是另一篇故事了。
參考文獻
[1]Krishtal OA, Pidoplichko VI. A receptor for protons in the membrane of sensory neurons may participate in nociception. Neuroscience. 1981;6(12):2599-2601. doi:https://doi.org/10.1016/0306-4522(81)90105-6
[2] Waxman SG, Zamponi GW. Regulating excitability of peripheral afferents: emerging ion channel targets. Nat Neurosci. 2014;17(2):153-163. doi:10.1038/nn.3602
[3] Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. The capsaicin receptor: a heat-activated ion channel in the pain pathway. Nature. 1997;389(6653):816-824. doi:10.1038/39807
[4] Smutzer G, Jacob JC, Tran JT, et al. Detection and modulation of capsaicin perception in the human oral cavity. Physiol Behav. 2018;194:120-131. doi:https://doi.org/10.1016/j.physbeh.2018.05.004
[5] Stevens RM, Ervin J, Nezzer J, et al. Randomized, Double-Blind, Placebo-Controlled Trial of Intraarticular Trans-Capsaicin for Pain Associated With Osteoarthritis of the Knee. Arthritis Rheumatol (Hoboken, NJ). 2019;71(9):1524-1533. doi:10.1002/art.40894
[6] Peier AM, Moqrich A, Hergarden AC, et al. A TRP Channel that Senses Cold Stimuli and Menthol. Cell. 2002;108(5):705-715. doi:https://doi.org/10.1016/S0092-8674(02)00652-9
[7] Story GM, Peier AM, Reeve AJ, et al. ANKTM1, a TRP-like Channel Expressed in Nociceptive Neurons, Is Activated by Cold Temperatures. Cell. 2003;112(6):819-829. doi:https://doi.org/10.1016/S0092-8674(03)00158-2
[8] Caterina MJ, Rosen TA, Tominaga M, Brake AJ, Julius D. A capsaicin-receptor homologue with a high threshold for noxious heat. Nature. 1999;398(6726):436-441. doi:10.1038/18906
[9] Vriens J, Owsianik G, Hofmann T, et al. TRPM3 Is a Nociceptor Channel Involved in the Detection of Noxious Heat. Neuron. 2011;70(3):482-494. doi:https://doi.org/10.1016/j.neuron.2011.02.051
[10] Singh AK, McGoldrick LL, Demirkhanyan L, Leslie M, Zakharian E, Sobolevsky AI. Structural basis of temperature sensation by the TRP channel TRPV3. Nat Struct Mol Biol. 2019;26(11):994-998. doi:10.1038/s41594-019-0318-7
[11] Güler AD, Lee H, Iida T, Shimizu I, Tominaga M, Caterina M. Heat-Evoked Activation of the Ion Channel, TRPV4. J Neurosci. 2002;22(15):6408 LP - 6414. doi:10.1523/JNEUROSCI.22-15-06408.2002
[12] Tan C-H, McNaughton PA. TRPM2 and warmth sensation. Pflügers Arch - Eur J Physiol. 2018;470(5):787-798. doi:10.1007/s00424-018-2139-7
[13] Talavera K, Yasumatsu K, Voets T, et al. Heat activation of TRPM5 underlies thermal sensitivity of sweet taste. Nature. 2005;438(7070):1022-1025. doi:10.1038/nature04248
[14] Zimmermann K, Lennerz JK, Hein A, et al. Transient receptor potential cation channel, subfamily C, member 5 (TRPC5) is a cold-transducer in the peripheral nervous system. Proc Natl Acad Sci. 2011;108(44):18114 LP - 18119. doi:10.1073/pnas.1115387108
[15] Tominaga M. The Role of TRP Channels in Thermosensation. In: ; 2006:271-286. doi:10.1201/9781420005844.ch20
[16] Bujak JK, Kosmala D, Szopa IM, Majchrzak K, Bednarczyk P. Inflammation, Cancer and Immunity—Implication of TRPV1 Channel. Front Oncol. 2019;9:1087. doi:10.3389/fonc.2019.01087
[17] Morice AH. TRPA1 receptors in chronic cough. Pulm Pharmacol Ther. 2017;47:42-44. doi:https://doi.org/10.1016/j.pupt.2017.05.004
[18] COSENS DJ, MANNING A. Abnormal Electroretinogram from a Drosophila Mutant. Nature. 1969;224(5216):285-287. doi:10.1038/224285a0
[19] MINKE B, WU C-F, PAK WL. Induction of photoreceptor voltage noise in the dark in Drosophila mutant. Nature. 1975;258(5530):84-87. doi:10.1038/258084a0
[20] Babes A, Sauer SK, Moparthi L, et al. Photosensitization in Porphyrias and Photodynamic Therapy Involves TRPA1 and TRPV1. J Neurosci. 2016;36(19):5264 LP - 5278. doi:10.1523/JNEUROSCI.4268-15.2016
[21] Hill K, Schaefer M. Ultraviolet light and photosensitising agents activate TRPA1 via generation of oxidative stress. Cell Calcium. 2009;45(2):155-164. doi:https://doi.org/10.1016/j.ceca.2008.08.001
[22] Cun-Jin S, Jian-Hao X, Xu L, et al. X-ray induces mechanical and heat allodynia in mouse via TRPA1 and TRPV1 activation. Mol Pain. 2019;15:1744806919849201. doi:10.1177/1744806919849201
[23] Rohacs T. Phosphoinositide signaling in somatosensory neurons. Adv Biol Regul. 2016;61:2-16. doi:https://doi.org/10.1016/j.jbior.2015.11.012
[24] Murthy SE, Dubin AE, Patapoutian A. Piezos thrive under pressure: Mechanically activated ion channels in health and disease. Nat Rev Mol Cell Biol. 2017;18(12):771-783. doi:10.1038/nrm.2017.92
作者:一一 | 編輯:EON
插畫:紀善生 | 排版:小葵花
本文為澎湃號作者或機構在澎湃新聞上傳并發布,僅代表該作者或機構觀點,不代表澎湃新聞的觀點或立場,澎湃新聞僅提供信息發布平臺。申請澎湃號請用電腦訪問http://renzheng.thepaper.cn。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業有限公司




