- +1
中國完成全球首個新冠隨機對照藥物臨床試驗,評價“克力芝”
新冠肺炎COVID-19的全球第一項隨機對照臨床試驗結(jié)果公布。北京時間3月19日,國家呼吸疾病臨床研究中心、中日友好醫(yī)院、武漢市金銀潭醫(yī)院、北京地壇醫(yī)院、北京協(xié)和醫(yī)學(xué)院等團(tuán)隊的研究人員聯(lián)合在頂級醫(yī)學(xué)期刊《新英格蘭醫(yī)學(xué)雜志》(NEJM)在線發(fā)表了研究論文“洛匹那韋-利托那韋(商品名‘克力芝’)治療重癥COVID-19成人住院患者的試驗”。
該項研究的通訊作者為中日友好醫(yī)院副院長、呼吸與危重癥醫(yī)學(xué)科主任曹彬,武漢市金銀潭醫(yī)院院長張定宇,中國工程院副院長、中國醫(yī)學(xué)科學(xué)院北京協(xié)和醫(yī)院院長、國家呼吸疾病臨床醫(yī)學(xué)研究中心主任王辰。

值得注意的是,這是新冠疫情暴發(fā)以來,世界頂級醫(yī)學(xué)雜志首次發(fā)表治療COVID-19的臨床試驗結(jié)果,也是在近20年新發(fā)傳染病疫情期間發(fā)表的屈指可數(shù)的藥物臨床試驗結(jié)果。
這項研究的總體結(jié)論為:在重癥COVID-19成人住院患者中,與標(biāo)準(zhǔn)治療相比,研究團(tuán)隊未觀察到洛匹那韋-利托那韋治療有益。
研究團(tuán)隊在討論環(huán)節(jié)提到,這項隨機試驗發(fā)現(xiàn),對COVID-19重癥患者采用洛匹那韋–利托那韋治療加標(biāo)準(zhǔn)支持治療,與僅提供標(biāo)準(zhǔn)支持治療相比,重癥患者的臨床改善或死亡率降低并不明顯。但是,在改良意向性治療分析中,研究排除了3名早期死亡的患者之后,兩組之間的臨床改善中位時間顯示出了差異,盡管幅度不大,但是有統(tǒng)計學(xué)顯著性,具體來說中位數(shù)是15天vs.16天。
該研究發(fā)現(xiàn):接受洛匹那韋-利托那韋治療的患者出現(xiàn)嚴(yán)重并發(fā)癥(急性腎損傷和繼發(fā)感染)或需要無創(chuàng)或有創(chuàng)機械通氣以治療呼吸衰竭的數(shù)量少于未接受治療的。根據(jù)這些觀察結(jié)果,研究團(tuán)隊表示,需要進(jìn)一步的研究以確定在特定疾病階段接受洛匹那韋–利托那韋治療,是否可以減少COVID-19的某些并發(fā)癥。
值得注意的是,該試驗的總體死亡率是22.1%,仍大大高于COVID-19住院患者的初步描述性研究報告中11%至14.5%的死亡率,這表明納入試驗的是重病患者。
洛匹那韋利托那韋是兩種蛋白酶抑制劑洛匹那韋和利托那韋構(gòu)成的合劑,商品名為克力芝。2000年被美國FDA批準(zhǔn)上市用于艾滋病的抗病毒治療,雖然服用藥物會帶來腹瀉、嘔吐、血脂高等副作用,但由于抗病毒效果好、耐藥屏障高,目前仍作為主要的抗HIV治療藥物應(yīng)用于臨床。值得一提的是,洛匹那韋利托那韋也是此次疫情暴發(fā)之后最早被使用的抗病毒老藥之一。
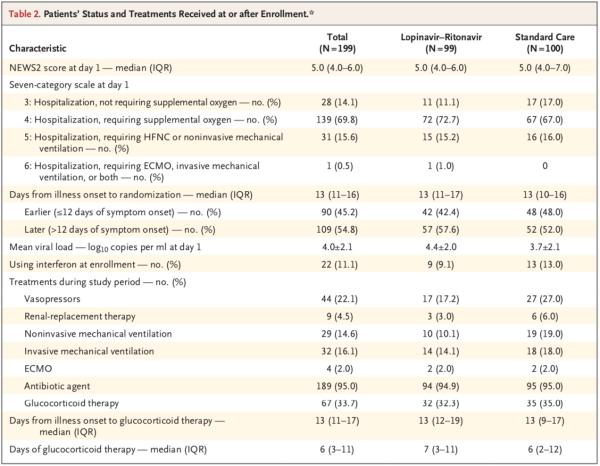
該臨床試驗于2020年1月9日通過倫理審查,1月18日至2020年2月3日(最后一例患者的入組日期)在武漢市金銀潭醫(yī)院開展。共計199例實驗室確診且符合入組條件的新冠病毒感染患者被隨機分組。其中100例被分配至標(biāo)準(zhǔn)治療組;99例被分配至洛匹那韋-利托那韋組,也就是說在標(biāo)準(zhǔn)治療的基礎(chǔ)上,增加洛匹那韋-利托那韋治療(各400mg、100mg,每日兩次,療程14天)。
值得注意的是,有5例被分配到洛匹那韋-利托那韋組的患者并未接受洛匹那韋-利托那韋治療(其中3人在24小時內(nèi)死亡),但為了最大限度地保留隨機化的信息,同樣被納入了意向治療(ITT)分析。研究團(tuán)隊同樣還進(jìn)行了一項排除3例早期死亡患者的改良意向性治療(mITT)分析。
但該項研究最終選取ITT分析集作為主要終點結(jié)果。這項研究的主要研究者在公眾號“NEJM醫(yī)學(xué)前沿” 撰寫的一份述評提到:每個科研攻關(guān)團(tuán)隊都希望本團(tuán)隊提出的干預(yù)措施和藥物顯示特效,我們作為該項目的研究者,也有著強烈的愿望,希望該藥物能夠有效。但是本著研究結(jié)果要經(jīng)得起質(zhì)疑和檢驗的原則,NEJM雜志編輯和我們都采取了謹(jǐn)慎的態(tài)度選取ITT分析集作為主要終點結(jié)果,為本文下主要結(jié)論,而并未選取mITT分析集的主要終點結(jié)果。
在ITT分析集中,洛匹那韋-利托那韋組中位改善時間16天,14天改善率45.5%,最終28天累計改善率78.8%;標(biāo)準(zhǔn)治療組,中位改善時間16天,14天改善率30%,最終28天累計改善率70%。兩組改善的風(fēng)險比(HR)是 1.31(95% CI,0.95-1.80),P=0.09。
在mITT分析集中,洛匹那韋/利托那韋組中位改善時間15天,14天改善率46.9%,最終28天累計改善率81.3%;標(biāo)準(zhǔn)治療組,中位改善時間16天,14天改善率30%,最終28天累計改善率70%。兩組改善的風(fēng)險比(HR)是 1.39(95% CI,1.00-1.91),P=0.0377。
此外,在亞組分析中,研究團(tuán)隊發(fā)現(xiàn)患者發(fā)病12天內(nèi)使用洛匹那韋/利托那韋,獲益趨勢更為明顯。
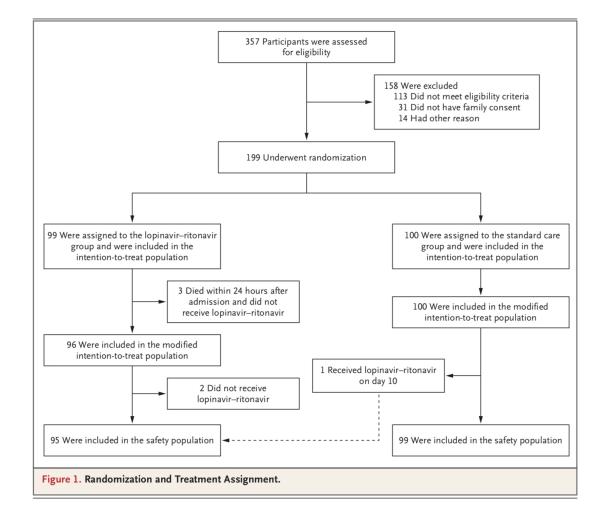
199例患者納入臨床試驗
從2019年12月開始, 新型冠狀病毒(SARS-CoV-2)在全球引發(fā)了稱為COVID-19的呼吸系統(tǒng)疾病暴發(fā)。COVID-19的完整疾病譜范圍是從輕度自限性呼吸道疾病到重度進(jìn)行性肺炎、多器官衰竭和死亡。迄今為止尚無針對冠狀病毒感染的特異性治療藥物。
此前的研究顯示,2003年嚴(yán)重急性呼吸系統(tǒng)綜合征(SARS)出現(xiàn)后,對已獲批準(zhǔn)的藥物進(jìn)行篩選后發(fā)現(xiàn),洛匹那韋(人類免疫缺陷病毒[HIV]1型的天冬氨酸蛋白酶抑制劑)對SARS-CoV病毒具有體外抑制活性。
論文提到,利托那韋與洛匹那韋聯(lián)用,主要是通過抑制細(xì)胞色素P450來延長洛匹那韋的血漿半衰期。2004年發(fā)表的一項開放標(biāo)簽研究提示,與僅接受利巴韋林治療的歷史對照組相比,利巴韋林加用洛匹那韋-利托那韋(分別為400 mg和100 mg)降低了SARS患者的不良臨床結(jié)局(急性呼吸窘迫綜合征ARDS或死亡)風(fēng)險以及病毒載量。
然而,由于上述研究未進(jìn)行隨機化,也沒有設(shè)置同期對照組,并且聯(lián)用了糖皮質(zhì)激素和利巴韋林,因此難以評估洛匹那韋-利托那韋的作用。
類似地,在體外試驗和動物模型中,洛匹那韋對中東呼吸系統(tǒng)綜合征冠狀病毒(MERS-CoV)均有活性。并且有病例報告指出,洛匹那韋-利托那韋與利巴韋林和干擾素(IFN)α聯(lián)用可清除病毒,使患者存活。
然而,目前尚無確實數(shù)據(jù)證明將該療法用于人體的療效。治療MERS的一項臨床試驗(聯(lián)用重組干擾素β-1b)目前正在進(jìn)行中(在ClinicalTrials.gov注冊號為NCT02845843)。
為了評估口服洛匹那韋-利托那韋治療新冠病毒感染的療效和安全性,研究團(tuán)隊在COVID-19成人住院患者中開展了一項隨機、對照、開放標(biāo)簽試驗LOTUS China(Lopinavir Trial for Suppression of SARS-Cov-2 in China)。
本試驗的納入標(biāo)準(zhǔn)如下:年齡≥18歲,診斷標(biāo)本的RT-PCR結(jié)果呈陽性,胸部影像學(xué)檢查確診肺炎,呼吸周圍空氣時氧飽和度(SaO2)≤94%或氧分壓(PaO2)與吸入氧濃度(FiO2)的比值(PaO2:FiO)≤300 mm Hg的男性和非妊娠期女性患者。
該項臨床研究2020年1月18日至2020年2月3日(最后一例患者的入組日期)在武漢市金銀潭醫(yī)院開展。
研究團(tuán)隊以1:1的比例將符合參與試驗標(biāo)準(zhǔn)的患者隨機分成兩組,分別接受為期14日的標(biāo)準(zhǔn)治療聯(lián)合每日兩次洛匹那韋-利托那韋(400 mg和100 mg,口服)治療、單獨接受標(biāo)準(zhǔn)治療。
根據(jù)患者的需要,標(biāo)準(zhǔn)治療包括吸氧、無創(chuàng)和有創(chuàng)通氣、抗生素、血管加壓藥、腎臟替代療法和體外膜氧合(ECMO)。
作為呼吸衰竭嚴(yán)重程度的指標(biāo),為了平衡兩組之間氧氣支持的分布情況,研究團(tuán)隊根據(jù)患者入組時的呼吸支持方法對隨機分組進(jìn)行了分層:無氧氣支持或者采用鼻導(dǎo)管或面罩的氧氣支持,或者高流量氧無創(chuàng)通氣,或者包括ECMO在內(nèi)的有創(chuàng)通氣。
在第0至至第28日、患者出院或患者死亡期間,由護(hù)士每日兩次根據(jù)日記卡評估患者狀況,日記卡中記錄了7分等級量表數(shù)據(jù)和安全性數(shù)據(jù)。
研究團(tuán)隊設(shè)置的主要終點是至臨床狀況改善的時間,其定義為從隨機分組至7分等級量表改善2分(與隨機分組時的狀況相比)或至出院的時間,以先發(fā)生的一項為準(zhǔn)。
等級量表在之前已被用作重癥流感住院患者臨床試驗的終點。7分等級量表包括以下等級:1.未住院,且可繼續(xù)從事日常活動;2.未住院,但無法繼續(xù)從事日常活動;3.住院治療,不需要吸氧;4.住院治療,需要吸氧;5.住院治療,需要經(jīng)鼻高流量氧療、無創(chuàng)機械通氣或這兩者;6.住院治療,需要ECMO、有創(chuàng)機械通氣或這兩者均需要;7.死亡。
其他臨床結(jié)局包括在第7日和第14日時采用7分等級量表評估的臨床狀況、28日死亡率、機械通氣持續(xù)時間、生存者的住院時長,以及從治療開始至死亡的時間(天數(shù))。病毒學(xué)指標(biāo)包括隨時間推移,檢出病毒RNA的患者比例,以及病毒RNA滴度曲線下面積(AUC)測定值。
安全性結(jié)局包括治療期間發(fā)生的不良事件、嚴(yán)重不良事件和提前停止治療。
研究團(tuán)隊在第1日(服用洛匹那韋-利托那韋之前)及第5、10、14、21和28日(直至患者出院或死亡)采集了患者的口咽拭子樣本,并進(jìn)行了實時RT-PCR檢測。并未因某一時間點的拭子檢測結(jié)果呈陰性而停止之后的樣本采集。
多項數(shù)據(jù)顯示兩組無明顯差異,胃腸道不良事件發(fā)生率較高
在被隨機分組的199例患者中,99例患者接受洛匹那韋-利托那韋治療,100例患者接受單獨標(biāo)準(zhǔn)治療。在洛匹那韋-利托那韋組的99例患者中,94例(94.9%)接受了分配的治療。
洛匹那韋-利托那韋組有5例患者未接受洛匹那韋-利托那韋治療,其中3例的原因是在隨機分組后24小時內(nèi)早期死亡,另外2例的原因是隨機分組后,主治醫(yī)師拒絕開出洛匹那韋-利托那韋。
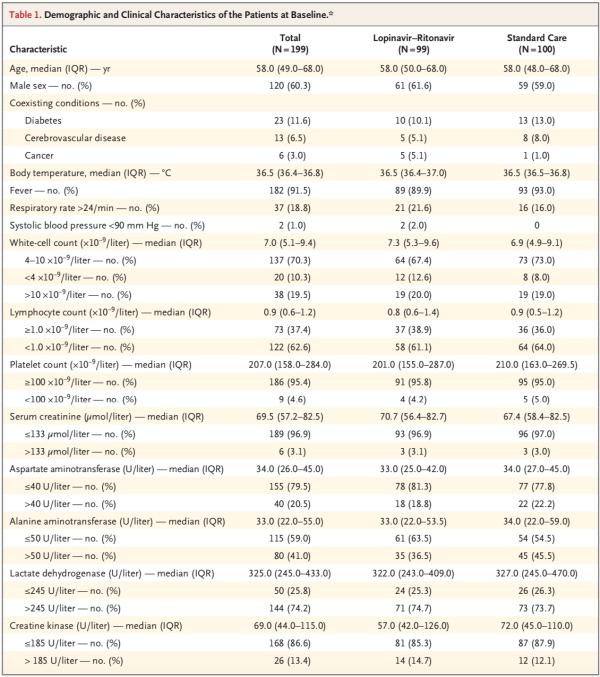
患者中位年齡為58歲(四分位距,49-68歲),男性患者占60.3%。出現(xiàn)癥狀和隨機分組的中位間隔時間為13天(四分位距,11-16天)。
在人口統(tǒng)計學(xué)特征、基線實驗室檢查結(jié)果、等級量表評分分布情況或入組時的NEWS2評分方面,兩組間無重要差異。在該試驗期間,洛匹那韋-利托那韋組和標(biāo)準(zhǔn)治療組接受全身糖皮質(zhì)激素治療患者的比例分別為33.0%、35.7%。
研究團(tuán)隊得出,在意向性治療人群中,洛匹那韋-利托那韋組和標(biāo)準(zhǔn)治療組患者至臨床狀況改善的時間無差異(中位數(shù),16天vs. 16天;臨床改善的風(fēng)險比,1.31;95%置信區(qū)間,0.95-1.85;P=0.09)。
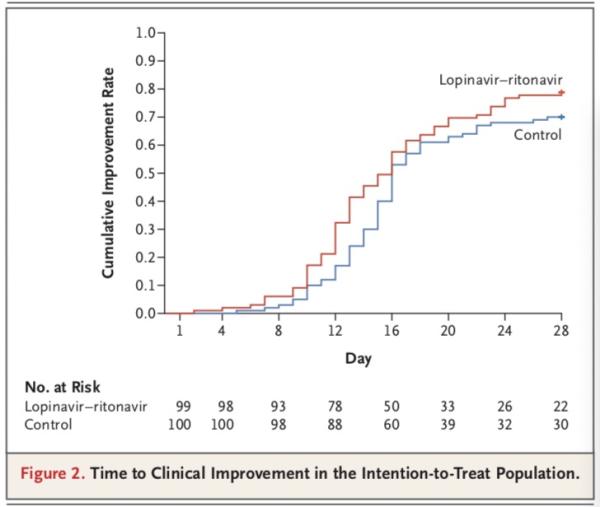
不過,在改良意向性治療人群中,洛匹那韋-利托那韋組和標(biāo)準(zhǔn)治療組患者至臨床狀況改善的中位時間分別為15天和16天(風(fēng)險比,1.39;95%置信區(qū)間,1.00-1.91)。
在意向治療人群中,癥狀出現(xiàn)后12日內(nèi)接受洛匹那韋-利托那韋治療與較早達(dá)到臨床狀況改善相關(guān)(風(fēng)險比,1.25;95%置信區(qū)間,1.77-2.05),而較晚接受洛匹那韋-利托那韋治療則與較早達(dá)到臨床狀況改善不相關(guān)(風(fēng)險比,1.30;95%置信區(qū)間,0.84-1.99)。
研究團(tuán)隊在討論環(huán)節(jié)提到,COVID-19患者在早期舊使用洛匹那韋–利托那韋治療是否可能具有臨床益處,這個問題很重要,也需要進(jìn)一步研究。該研究發(fā)現(xiàn)與新冠病毒性肺炎在疾病的第二周內(nèi)進(jìn)展相符,并且與先前在SARS和嚴(yán)重流感中進(jìn)行的抗病毒研究中觀察到的治療時間效應(yīng)也相符。
在意向治療人群中,如果根據(jù)入組時的NEWS2評分對至臨床狀況改善的時間進(jìn)行評估,未觀察到顯著差異。此外,兩組之間至臨床狀況惡化(定義為7分量表評分加重1分)的時間也無差異(臨床改善的風(fēng)險比,1.01;95%置信區(qū)間,0.76-1.34)。
次要結(jié)局方面,在意向性治療人群(19.2% vs. 25.0%;差異,-5.8個百分點;95%置信區(qū)間,-17.3-5.7)或改良意向性治療人群(16.7% vs. 25.0%;差異,-8.3個百分點;95% CI,-19.6-3)中,洛匹那韋-利托那韋組的28日死亡率在數(shù)值上均低于標(biāo)準(zhǔn)治療組。
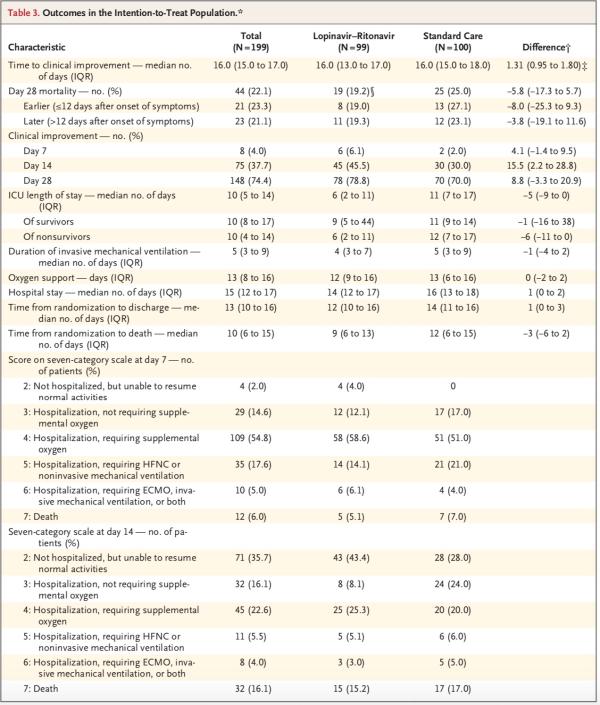
洛匹那韋-利托那韋組患者的重癥監(jiān)護(hù)病房(ICU)住院時間比標(biāo)準(zhǔn)治療組患者短(中位數(shù),6天vs. 11天;差異,-5天;95% CI,-9-0),并且從隨機分組至出院的時間比標(biāo)準(zhǔn)治療組短(中位數(shù),12天vs. 14天;差異,1天;95% CI,0-3)。此外,第14日時,洛匹那韋-利托那韋組中臨床狀況改善的患者百分比高于常規(guī)治療組(45.5% vs. 30.0%;差異,15.5個百分點;95% CI,2.2-28.8)。
其他結(jié)局(例如吸氧持續(xù)時間、住院時長和從隨機分組至死亡的時間)無顯著差異。
病毒學(xué)方面,隨機分組時,洛匹那韋-利托那韋組患者咽拭子樣本(獲取知情同意后采集的樣本)的基線病毒RNA載量平均值(±SD)略高于常規(guī)治療組(4.4±2.0 log10 拷貝/毫升 vs. 3.7±2.1 log10拷貝/毫升)。
隨著時間的推移,洛匹那韋-利托那韋組患者和標(biāo)準(zhǔn)治療組患者的病毒RNA載量無差異,包括根據(jù)患病時間進(jìn)行的分析)。
在任何采樣時間上,洛匹那韋-利托那韋組和標(biāo)準(zhǔn)治療組可檢出新冠病毒RNA的患者百分比均相似(第5日,34.5% vs. 32.9%;第10日,50.0% vs. 48.6%;第14日,55.2% vs. 57.1%;第21日,58.6% vs. 58.6%;第28日,60.3% vs. 58.6%)。
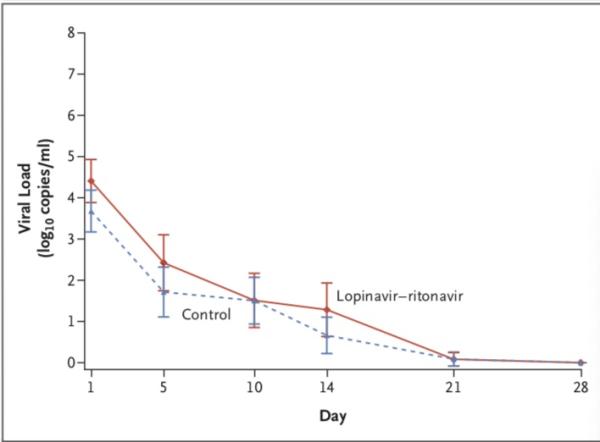
研究團(tuán)隊認(rèn)為,與單獨的標(biāo)準(zhǔn)支持治療相比,未發(fā)現(xiàn)加入洛匹那韋–利托那韋治療可減少病毒RNA載量,也未發(fā)現(xiàn)患者病毒RNA可檢測時間的縮短。在試驗結(jié)束時(第28天),仍在洛匹那韋–利托那韋治療組的40.7%的患者中仍檢測到新冠病毒的RNA。最近的一份報告顯示,在嚴(yán)重疾病患者中,COVID-19的排毒時間中位時間為20天,有的可能長達(dá)37天。
該研究或當(dāng)前研究均未發(fā)現(xiàn)洛匹那韋-利托那韋發(fā)揮重要抗病毒作用的證據(jù)。洛匹那韋–利托那韋對新冠病毒肺炎患者的治療缺乏抗病毒作用的原因尚不確定,“但當(dāng)前試驗中使用的采樣方法很可能也不是最佳的選擇。”
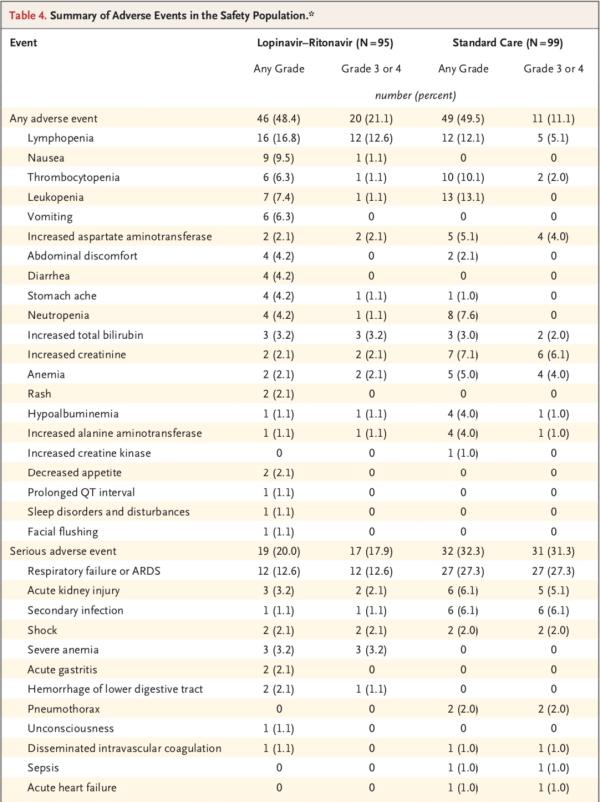
安全性研究顯示,隨機分組至第28日期間,洛匹那韋-利托那韋組和標(biāo)準(zhǔn)治療組分別有46例患者(48.4%)、49例患者(49.5%)報告了不良事件。洛匹那韋-利托那韋組中胃腸道不良事件(包括惡心、嘔吐和腹瀉)的發(fā)生率高于常規(guī)治療組。兩組中有實驗室檢查結(jié)果異常的患者百分比相似。
共計51例患者發(fā)生了嚴(yán)重不良事件:洛匹那韋-利托那韋組19例和標(biāo)準(zhǔn)治療組32例(表4)。洛匹那韋-利托那韋組發(fā)生了4起胃腸道嚴(yán)重不良事件,而標(biāo)準(zhǔn)治療組未發(fā)生胃腸道嚴(yán)重不良事件。研究團(tuán)隊判定這4起事件均與試驗藥物相關(guān)。而標(biāo)準(zhǔn)治療組患者的呼吸衰竭、急性腎損傷和繼發(fā)感染發(fā)生率高于洛匹那韋-利托那韋組。
研究團(tuán)隊提到,在本試驗中觀察到的副作用引起了人們對使用更高或更長的洛匹那韋-利托那韋劑量方案以改善結(jié)局的擔(dān)憂。
研究團(tuán)隊還判定,觀察期間的所有死亡均與干預(yù)無關(guān)。
總體來說,研究團(tuán)隊發(fā)現(xiàn)對于嚴(yán)重的COVID-19患者,洛匹那韋–利托那韋治療并不能顯著加速患者的臨床改善、降低死亡率或降低咽喉病毒RNA的可檢測性。這些早期數(shù)據(jù)能為將來的研究提供參考,以評估該藥物和其他藥物治療新冠病毒感染的可能性。
新發(fā)傳染病特效藥的窘境:有效治療措施的探索時間窗極為狹窄
值得注意的是,該項研究的主要研究在前述述評文章中還披露了該項臨床試驗背后的一些信息。
首先,為什么選擇洛匹那韋-利托那韋做臨床試驗,以及為什么選擇在金銀潭醫(yī)院開展?
張定宇此前曾有所透露,“我們有一個先天的優(yōu)勢,因為洛匹那韋/利托那韋是抗艾滋藥,我們醫(yī)院是管艾滋病的,全省的艾滋病藥全部在我們這。當(dāng)時想著一個病人按14天來算,大概是需要56顆藥,一瓶藥120粒,可以給兩個病人吃。按照這個算法我們大概有1000人份的藥。所以我們很快在臨床展開了,鼓勵一些科室主任,如果有重病人的話,趕快給這個藥,說不定有用。”
主要研究者在上述述評中寫道:在疫情初期,面對部分重癥患者病情快速惡化和難以逆轉(zhuǎn)的難題,我們一直在思考有什么藥物能夠救治更多重癥患者?
“其實我們對提出洛匹那韋/利托那韋的建議是很忐忑的,害怕醫(yī)生不理解,甚至產(chǎn)生了退而求其次做隊列觀察的念頭。但是,張定宇院長和他的團(tuán)隊給了中日醫(yī)院團(tuán)隊堅定的支持。最后中日醫(yī)院和金銀潭醫(yī)院兩個團(tuán)隊合作共同完成COVID-19的全球第一項隨機對照臨床試驗。”
他們同時提到,瑞德西韋是列為最重要評價的藥物,因為該藥體外抗病毒活性最強,動物實驗驗證有效,有I/II/III臨床試驗數(shù)據(jù)。“但由于瑞德西韋全球未上市,臨床可及性不足,因此我們把瑞德西韋列為第二需要評價的藥物。”
然而,該臨床試驗1月9日完成立項,但直到1月18日正式隨機入組第一例患者,期間曲折頗多。
其中之一包括臨床試驗的注冊。研究團(tuán)隊希望盡快在相應(yīng)的臨床試驗平臺上注冊、公開研究信息,讓同行監(jiān)督保證臨床試驗公開透明。但ClinicalTrials.gov注冊網(wǎng)站以“COVID-19是地方性疾病”拒絕我們注冊,后改在中國臨床試驗注冊平臺上登記注冊成功,但是因此而耽誤了寶貴的時間。當(dāng)他們完成該臨床試驗注冊時,已經(jīng)在入組第1例患者之后。
述評中寫道,“這真是一個莫大的諷刺,1月初的時候,ClinicalTrials.gov注冊網(wǎng)站怎么也沒有想到短短兩個月后COVID-19已經(jīng)席卷全球。”
并且,在中日友好醫(yī)院團(tuán)隊1月9日返回北京參加其他疫情防控后的1周時間里,隨機系統(tǒng)中隨機人數(shù)一直都是0。多次溝通后發(fā)現(xiàn)項目進(jìn)展困難,“張定宇院長團(tuán)隊先說服臨床醫(yī)生在少數(shù)患者中嘗試了使用,并發(fā)現(xiàn)吸入干擾素的操作會增加臨床執(zhí)行的困難,增加氣溶膠暴露的風(fēng)險。”
最后,研究團(tuán)隊對方案進(jìn)行了修改,改用洛匹那韋-利托那韋單用作為干預(yù)措施。
中日友好醫(yī)院團(tuán)隊1月23日再次回到金銀潭醫(yī)院。“我們不禁感慨萬千,武漢當(dāng)時疫情形式的嚴(yán)峻超過了我的想象。”
研究者們提到,面對新發(fā)突發(fā)呼吸道傳染病,快速明確有效治療藥物十分困難。在嘗試治療SARS 和MERS的歷史中,因諸多原因兩次次錯失證明洛匹那韋-利托那韋療效和安全性的機會。
“連續(xù)錯失兩次探索治療冠狀病毒藥物的機會,間接導(dǎo)致此次COVID-19全球流行無確切抗病毒藥物的窘境。”研究團(tuán)隊認(rèn)為,面對新發(fā)突發(fā)呼吸道傳染病,有效治療措施的探索時間窗極為狹窄,需要集中最寶貴的資源優(yōu)先評價幾種具有充分潛力的藥物。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯(lián)網(wǎng)新聞信息服務(wù)許可證:31120170006
增值電信業(yè)務(wù)經(jīng)營許可證:滬B2-2017116
? 2014-2025 上海東方報業(yè)有限公司




