- +1
Nature子刊:異體NK細胞可精準清除癌前細胞
在大多數人的印象中,癌癥像是一場突如其來的事故,今天一切正常,明天卻突然被判“晚期”。但事實遠比直覺更復雜。
癌變并非某一時刻突然發生的斷裂,而是一個“被放過、被放任”的長期過程。人體免疫系統,原本負責清除異常細胞、識別惡性傾向,是這場戰斗的第一道防線。然而,當這道防線悄無聲息地垮塌時,癌癥才有了發芽的機會。
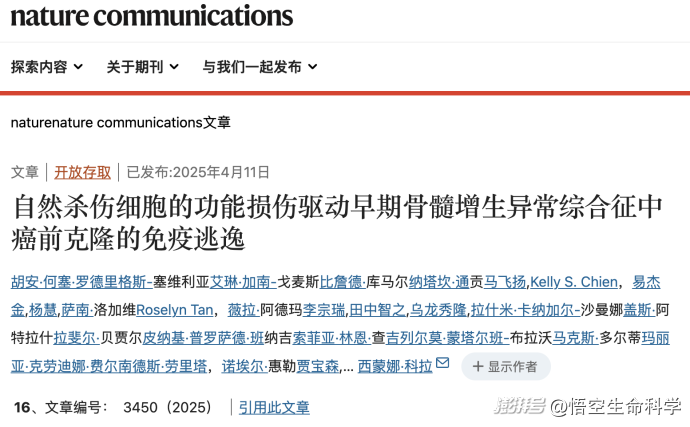
2025年,《Nature Communications》刊登的一項研究首次實證:在骨髓增生異常綜合征(MDS)的前驅階段,即所謂“癌前狀態”CCUS(Clonal Cytopenia of Undetermined Significance)中,正是自然殺傷細胞(NK細胞)率先發生功能性失調,為異常克隆細胞的存活與擴張開了綠燈。
更重要的是,研究團隊還發現,源自健康供體的異體NK細胞能夠精準識別并清除這些前癌細胞,而不會誤傷正常造血細胞。這意味著,癌前免疫干預的現實可能正在到來,且路徑清晰、手段成熟,關鍵就在于“誰來出手”。
01 從克隆異常到血癌,免疫系統的沉默是一切的起點
CCUS常被誤認為是一種“觀察期”的病理狀態,患者造血功能輕度異常,骨髓中出現一些突變的細胞克隆,但尚未達到MDS的診斷標準。
臨床上,多數醫生仍將其視為“未必發展”的灰區,不建議治療。但研究顯示,超過80%的CCUS患者在5年內將發展為MDS,極少數甚至可直接進展為急性白血病。這不是偶然,而是一個潛移默化、由免疫失控驅動的漸變鏈條。
本研究通過對早期MDS和CCUS患者的骨髓樣本進行單細胞組學分析,發現一個值得警覺的趨勢:這些患者體內的NK細胞雖然數量尚可,表面活化指標也存在,但其功能性卻嚴重衰減。
它們不再釋放有效的細胞毒素,無法有效識別帶有突變標記的異常細胞。更值得注意的是,部分功能失常的NK細胞自身也攜帶造血干細胞層級的突變,說明這一免疫亞群已經“被污染”,無法維持應有的免疫監視作用。
這意味著,癌癥從不是某一細胞孤立作亂的結果,而是一場系統性放權。當NK細胞停止執行清除命令,前癌克隆便得以逐步擴張,最終形成不可逆的病理改變。免疫防線的瓦解,不是因為外力強大,而是因為內部失控。
02 異體NK細胞的精準清除能力,為癌前干預打開新路徑
面對患者自體NK細胞的功能衰竭,研究團隊進一步設計了驗證實驗。他們將帶有前癌突變克隆的人類造血干細胞移植至人源化免疫缺陷小鼠體內,分別注射來自患者自身與健康供體的NK細胞。
實驗結果展現了顯著反差:患者自體NK細胞幾乎毫無清除能力,而健康供體的異體NK細胞能夠精準地將帶突變標記的克隆細胞識別并殺傷,同時保留正常造血系統的完整性。
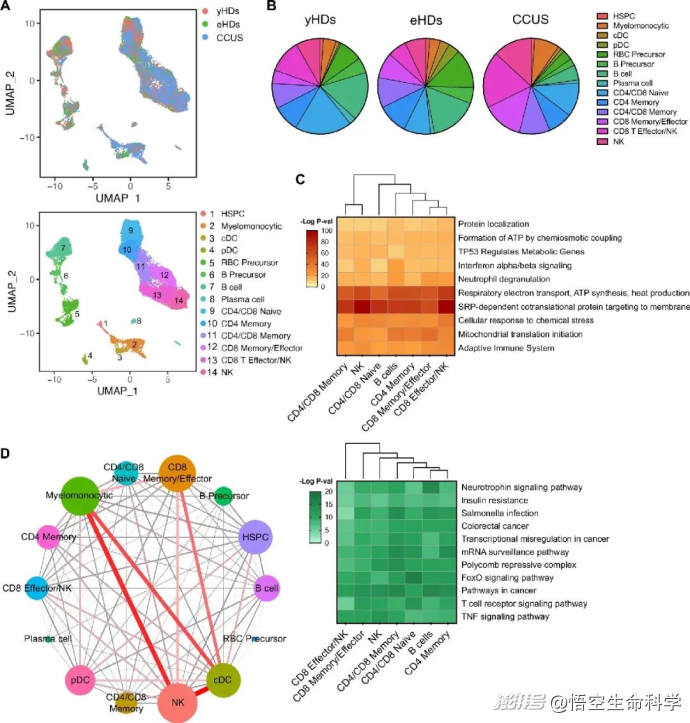
▲CCUS 患者的免疫細胞被激活
這不僅僅是一次機制層面的突破,更是臨床策略上的顛覆。過去,免疫治療幾乎默認“癌癥已經發生”,重點放在中晚期控制、延長生存或減緩復發。
而本研究首次將治療窗口前移至癌變發生之前,證明異體免疫干預不僅理論可行,且具備“高識別率+低毒副反應”的雙重優勢,提供了一種不依賴化療、不需造血干細胞移植的早期清除方案。
對那些被標注為“觀察隨訪”的CCUS患者而言,這意味著或許不再需要等待病情進展才啟動治療,而是有機會通過“免疫接管”,提前阻斷惡變通路。這一發現為NK細胞療法在早篩人群中的應用奠定了理論基礎。
03 免疫治療從“抗癌”走向“防癌”,臨床邊界正在改寫
當前,免疫細胞治療仍以治療中晚期腫瘤為主要適應癥,NK細胞亦多用于實體瘤、白血病復發后的靶向輔助。
然而,從“癌后控制”轉向“癌前防線”,已成為全球免疫醫學研究的重要趨勢。以往由于缺乏明確機制、缺乏前瞻性指標、缺乏高選擇性的免疫武器,癌前干預在臨床上始終是“理想大于現實”。
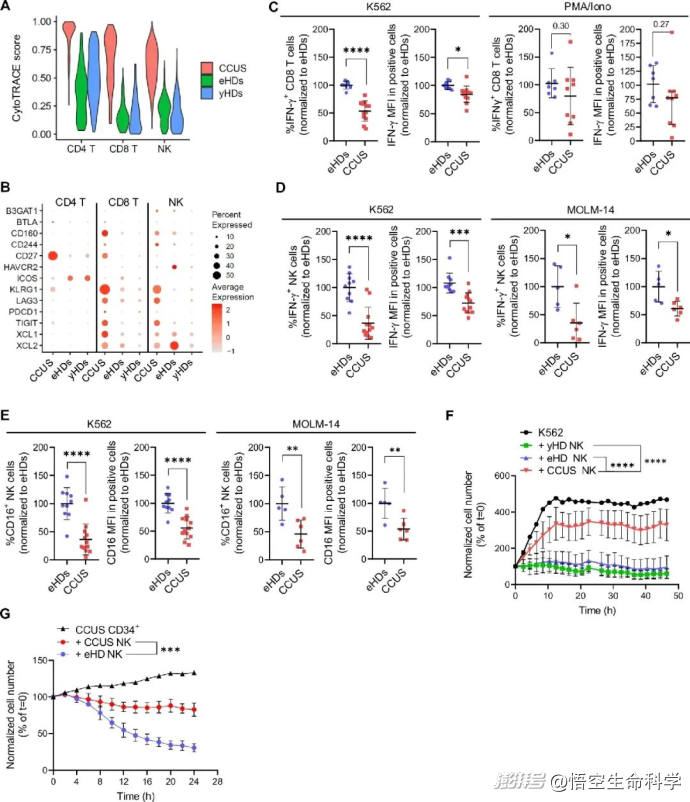
▲CCUS 患者的NK細胞功能失調
而此次Nature子刊發表的實證研究正是填補這三大缺口的關鍵一環:
首先,機制上明確了NK細胞功能失調是癌前狀態的決定性轉折點,甚至優于傳統的基因突變數量預測;
其次,模型驗證提供了可控可視的靶向窗口,實驗動物中的清除效果非常接近真實人體情況;
第三,更重要的是,異體NK細胞來源于健康供體,無需配型匹配,也不引發移植物抗宿主病(GVHD),具有即時應用的現實優勢。
臨床上,一旦與現有的高通量篩查技術(如cfDNA突變檢測、骨髓微環境評估)結合,將為高危人群定制“免疫阻斷干預計劃”成為可能。未來,我們或許可以不再等待癌癥成形,而是像預防乙肝那樣,在疾病啟動前完成免疫“封殺”。
04 從精準篩查到個體化免疫介入,NK療法可成為“無創癌前疫苗”
事實上,癌癥從發生到發現,有時要經歷3至7年的“潛伏期”。在這個階段里,患者癥狀輕微,影像學和常規指標都不足以發出警報,而異常克隆卻已在骨髓或其他組織中悄然扎根。依靠常規體檢進行發現幾乎不可能,傳統的“等它成形再治療”模式嚴重滯后。
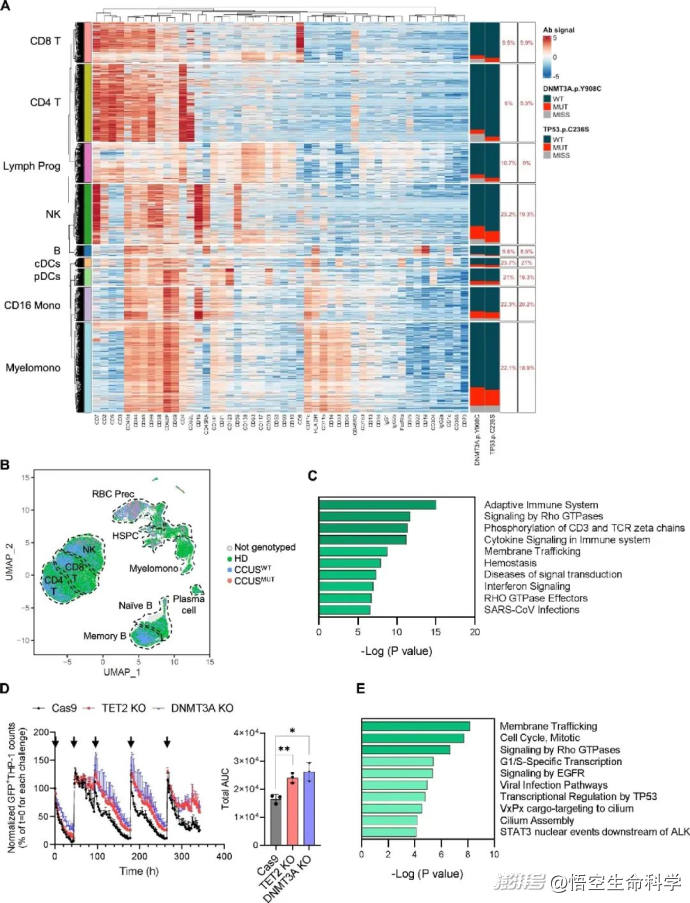
▲MDS驅動基因的體細胞突變誘導CCUS NK細胞功能障礙
正因如此,基于免疫機制的個體化干預正在成為精準醫學的下一個高地。NK細胞天生具備對非典型異常信號的“先天識別”能力,天然不依賴抗原呈遞,也不需要T細胞激活,這使它們在面對非典型腫瘤前體時依然具備識別與殺傷優勢。
而通過異體NK細胞的制備、冷凍、標準化運輸,建立“癌前免疫疫苗庫”成為現實可能。
更進一步,未來甚至可以在特定人群中實現——篩查-識別-干預的三步走閉環:
1、檢測發現攜帶高危突變、克隆性異常,但尚未進入癌變;
2、注射個性化擴增的異體NK細胞進行“先清除”;
3、后續通過干細胞營養支持或菌群重建,重啟自身免疫修復功能。
這種模式一旦成熟,不僅可適用于MDS、CCUS,也有望拓展至乳腺不典型增生、胃腸道異型增生、口腔黏膜白斑等“癌前可逆區”。NK細胞不再只是“晚期的陪練”,而將成為“癌前阻擊”的正面戰士。
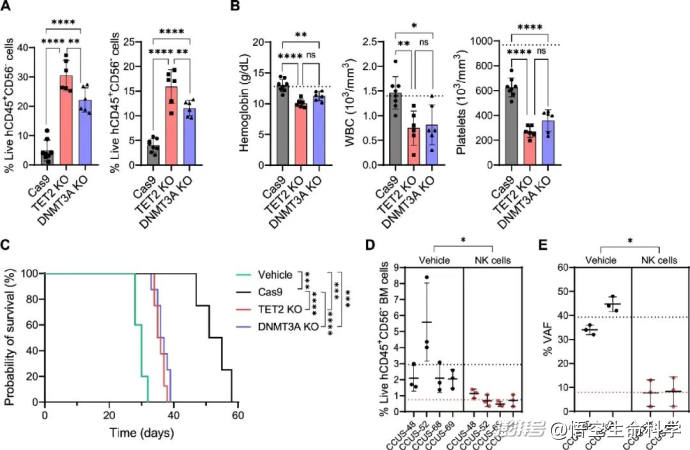
▲來自HD的NK細胞有效地靶向CCUS突變細胞
05 重建防線,比亡羊補牢更重要一百倍
腫瘤治療的最理想狀態,從來都不是“拖住它”,而是“讓它永遠別來”。這聽上去像是預防醫學的范疇,但這項研究告訴我們,它完全可以是“免疫治療”的主戰場。不是一味延長患者存活,而是徹底阻斷病變路徑,在起點處設立清除機制。
異體NK細胞的崛起,正是這種思維變革的產物。它代表著醫學從病理打擊向生理預警的跨越,從以病灶為中心轉向以免疫能力為核心。
未來,醫生可能不再說“你的指標還在正常范圍,先觀察”,而是說“你的免疫識別功能正在減退,可以考慮早期NK干預”;體檢報告也不僅是紅字提醒,而是免疫評分+干預推薦,癌癥成為可以預防、可監控的代謝過程,而非命運突襲。
當人類開始主動重建自己身體里的防御體系,很多我們以為不可阻擋的疾病,其實都可以被提前拒之門外。
本文為澎湃號作者或機構在澎湃新聞上傳并發布,僅代表該作者或機構觀點,不代表澎湃新聞的觀點或立場,澎湃新聞僅提供信息發布平臺。申請澎湃號請用電腦訪問http://renzheng.thepaper.cn。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業有限公司




