- +1
哈佛醫(yī)學(xué)院研究發(fā)現(xiàn):激活B細(xì)胞,可提升TIL細(xì)胞療法成功率2倍
在癌癥治療領(lǐng)域,TIL(腫瘤浸潤(rùn)性淋巴細(xì)胞)療法曾被譽(yù)為最有希望的個(gè)體化免疫療法之一。
然而,如何穩(wěn)定高效地?cái)U(kuò)增TIL細(xì)胞,始終是制約其普及和療效提升的關(guān)鍵難題。
近日,哈佛醫(yī)學(xué)院附屬達(dá)納-法伯癌癥研究院團(tuán)隊(duì)發(fā)布重磅研究:通過(guò)激活腫瘤局部的B細(xì)胞,僅僅一個(gè)環(huán)節(jié)的改進(jìn),就能將TIL擴(kuò)增成功率提高近2倍,從33%躍升至67%。
這一發(fā)現(xiàn)不僅刷新了對(duì)腫瘤免疫微環(huán)境的理解,也為提升TIL療法的治療效果、加速其應(yīng)用普及,打開了新的突破口。
細(xì)胞戰(zhàn)爭(zhēng)的戰(zhàn)局,正在被悄悄改寫。
01 TIL療法:曾被寄予厚望,也面臨現(xiàn)實(shí)難題
TIL療法,即腫瘤浸潤(rùn)性淋巴細(xì)胞治療(Tumor-Infiltrating Lymphocyte Therapy),是一種高度個(gè)體化的免疫療法。
它的基本邏輯簡(jiǎn)單而有力:從患者自身腫瘤組織中提取已經(jīng)自然滲透進(jìn)去的T細(xì)胞,這些T細(xì)胞本身具備識(shí)別并攻擊腫瘤細(xì)胞的潛力。經(jīng)過(guò)體外擴(kuò)增和激活后,再大劑量回輸體內(nèi),強(qiáng)化免疫攻擊力,從而清除癌細(xì)胞。
TIL療法的臨床效果令人振奮。在黑色素瘤、宮頸癌、非小細(xì)胞肺癌等實(shí)體瘤中,部分患者實(shí)現(xiàn)了深度緩解,甚至完全緩解。
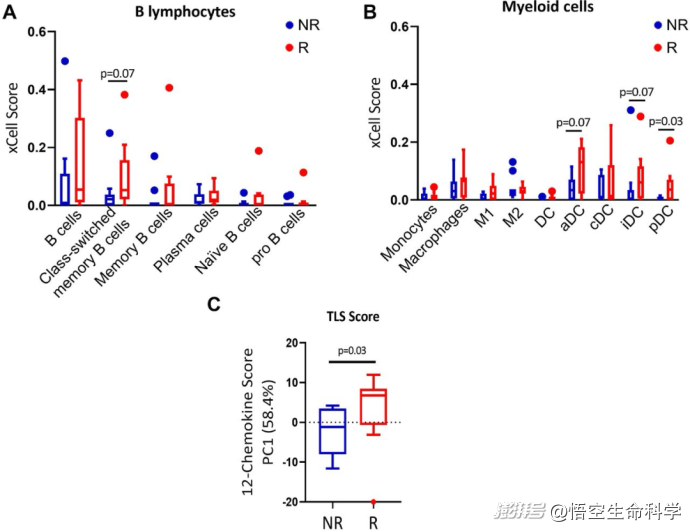
黑色素瘤TIL治療的反應(yīng)者(R)和非反應(yīng)者(NR)的免疫細(xì)胞含量分析
美國(guó)FDA也于2024年批準(zhǔn)了首款TIL療法(Lifileucel)用于晚期黑色素瘤患者,標(biāo)志著這一療法正式進(jìn)入主流癌癥治療體系。
然而,TIL療法的推廣并不容易,最大的問題在于:
擴(kuò)增難度高:并非每個(gè)患者的TIL都能在體外順利擴(kuò)增到治療所需數(shù)量;
擴(kuò)增失敗率高:傳統(tǒng)流程下,TIL擴(kuò)增成功率僅約30%-40%;
細(xì)胞質(zhì)量參差不齊:即便擴(kuò)增成功,不同患者TIL中抗腫瘤活性的T細(xì)胞比例差異巨大,影響治療效果。
換句話說(shuō),TIL療法就像一場(chǎng)賭博,很多時(shí)候并不是醫(yī)生技術(shù)不到位,而是患者腫瘤組織內(nèi)本身缺乏足夠有戰(zhàn)斗力的細(xì)胞種子。
因此,如何提升TIL擴(kuò)增成功率、提高細(xì)胞質(zhì)量,成為制約這一療法全面普及的核心瓶頸。
哈佛醫(yī)學(xué)院附屬達(dá)納-法伯癌癥研究院團(tuán)隊(duì),正是瞄準(zhǔn)了這個(gè)“擴(kuò)增困局”,提出了一個(gè)出人意料又極具說(shuō)服力的解法:激活腫瘤微環(huán)境中的B細(xì)胞。
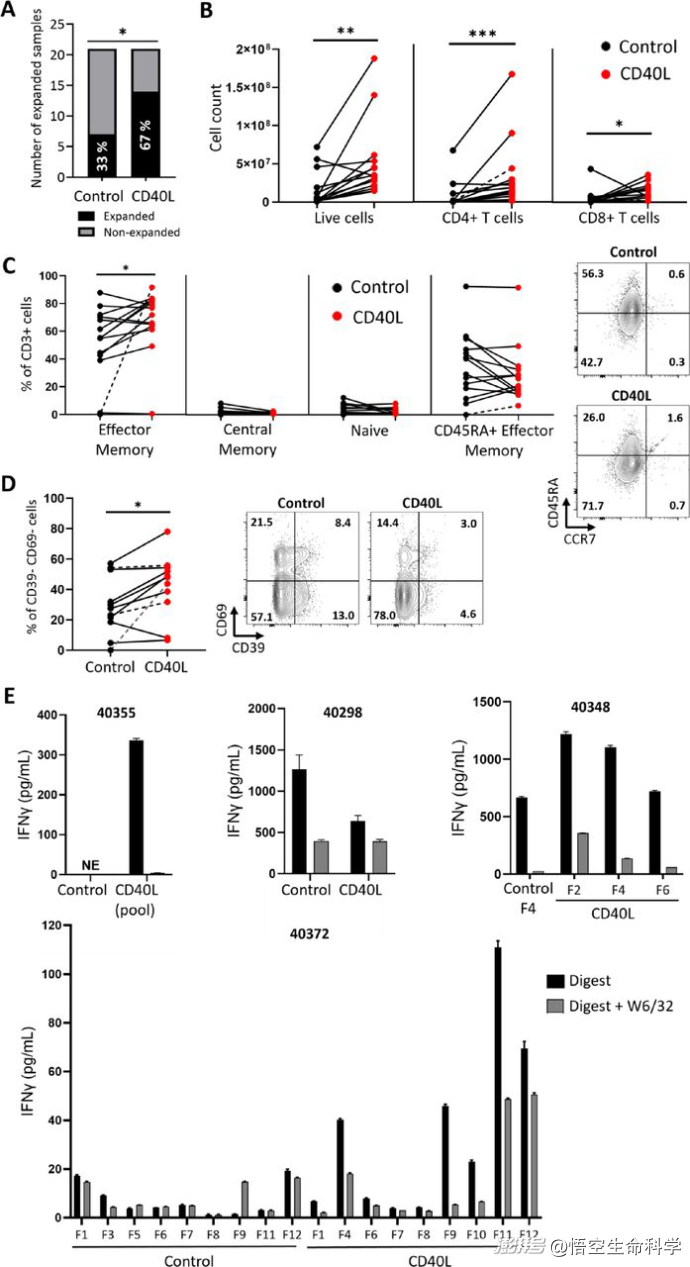
CD40L增強(qiáng)了黑色素瘤TIL的擴(kuò)張。黑色素瘤單細(xì)胞懸浮液在標(biāo)準(zhǔn)TIL膨脹培養(yǎng)基(對(duì)照)或補(bǔ)充CD40(CD40L)激動(dòng)劑的培養(yǎng)基中培養(yǎng)3-4周
02 哈佛團(tuán)隊(duì)新發(fā)現(xiàn):激活B細(xì)胞,TIL擴(kuò)增成功率翻倍
在這項(xiàng)由哈佛醫(yī)學(xué)院附屬達(dá)納-法伯癌癥研究院主導(dǎo)的研究中,科學(xué)家們提出了一個(gè)顛覆傳統(tǒng)的假設(shè):腫瘤組織中的B細(xì)胞,不是旁觀者,而是TIL擴(kuò)增成功與否的重要推手。
通過(guò)對(duì)黑色素瘤患者樣本的系統(tǒng)分析,研究團(tuán)隊(duì)發(fā)現(xiàn):
TIL擴(kuò)增成功的患者腫瘤組織中,B細(xì)胞尤其是“類切換記憶B細(xì)胞(class-switched memory B-cells)”的比例顯著更高(p=0.007)。
三次淋巴結(jié)構(gòu)(TLS,類似小型淋巴結(jié)的微環(huán)境結(jié)構(gòu))評(píng)分也更高(p=0.03),而TLS往往富含活躍的B細(xì)胞群體。
進(jìn)一步的實(shí)驗(yàn)驗(yàn)證了B細(xì)胞在TIL擴(kuò)增過(guò)程中的重要性。
研究者在傳統(tǒng)TIL擴(kuò)增體系中,加入了CD40配體(CD40L)——一種能強(qiáng)烈激活B細(xì)胞的分子信號(hào)。
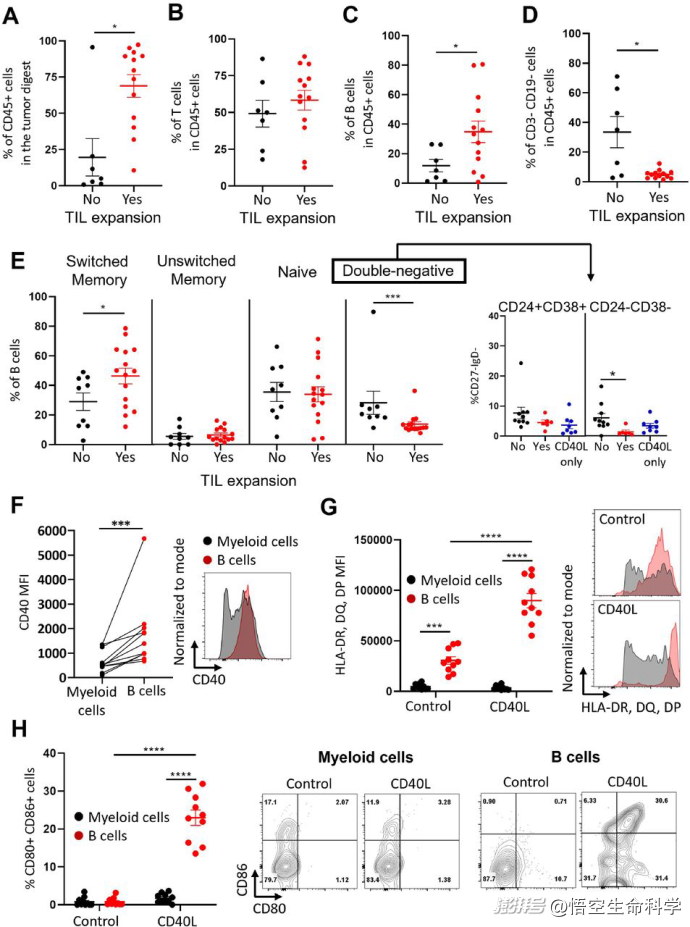
浸潤(rùn)的黑色素瘤B細(xì)胞對(duì)CD40L的反應(yīng)對(duì)配體進(jìn)行上調(diào)
結(jié)果非常驚人:加入CD40L后,TIL擴(kuò)增成功率從原本的33%躍升至67%(p=0.03),接近翻倍;擴(kuò)增出來(lái)的TIL中,具有更年輕表型(CD39- CD69-)的T細(xì)胞比例更高;新抗原特異性的T細(xì)胞克隆數(shù)量明顯增加,提示抗腫瘤活性更強(qiáng)。
不僅在黑色素瘤中,在非小細(xì)胞肺癌(NSCLC)樣本中,CD40L激活策略同樣有效——TIL擴(kuò)增速度加快(節(jié)省一周培養(yǎng)時(shí)間);新抗原反應(yīng)性T細(xì)胞數(shù)量增加(p≤0.01)。
更深入的單細(xì)胞轉(zhuǎn)錄組分析揭示,CD40L幾乎專門刺激了腫瘤B細(xì)胞,誘導(dǎo)它們上調(diào)共刺激分子(如CD83、CD58)和趨化因子(如CCL22、CCL17),從而為T細(xì)胞擴(kuò)增創(chuàng)造了更有利的局部免疫環(huán)境。
簡(jiǎn)而言之,CD40L激活B細(xì)胞,就像在腫瘤微環(huán)境中點(diǎn)燃了一場(chǎng)“細(xì)胞動(dòng)員令”,讓沉睡的T細(xì)胞得到更好支持、迅速成長(zhǎng)為可以用于治療的免疫大軍。
03 激活B細(xì)胞:一場(chǎng)改變TIL療法未來(lái)格局的微創(chuàng)新
在以往的癌癥免疫治療研究中,B細(xì)胞往往被忽略。
人們習(xí)慣將注意力集中在T細(xì)胞,尤其是殺傷性T細(xì)胞(CD8+ T細(xì)胞)上,認(rèn)為它們是對(duì)抗腫瘤的主力軍。
但哈佛醫(yī)學(xué)院附屬達(dá)納-法伯團(tuán)隊(duì)的這項(xiàng)研究顛覆了這一傳統(tǒng)認(rèn)知:B細(xì)胞不僅是“配角”,在TIL擴(kuò)增乃至療效提升中,可能是關(guān)鍵的“助推器”。
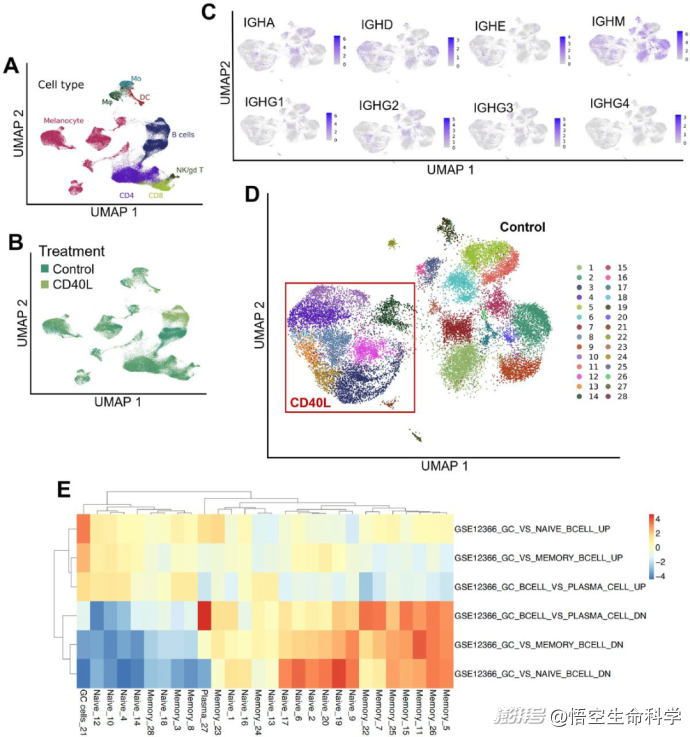
(A)腫瘤消化中識(shí)別的不同細(xì)胞群的UMAP投影。(B)基于培養(yǎng)條件(CD40L與對(duì)照)的腫瘤消化的UMAP投影。(C)B細(xì)胞的UMAP投影,顯示IgA、IgD、IgE、IgG1、IgG2、IgG3、IgG4和IgM抗體/BCR同型的表達(dá)。(D)B細(xì)胞的UMAP投影顯示由Seurat算法識(shí)別的子聚類。與CD40L處理樣品對(duì)應(yīng)的集群用紅方表示。(E)將B細(xì)胞集群與之前描述的基因集與原始、記憶、胚胎中心(GC)和漿細(xì)胞相對(duì)應(yīng)的基因集交叉引用
具體來(lái)說(shuō),B細(xì)胞在CD40L刺激下扮演了兩重角色:
增強(qiáng)T細(xì)胞擴(kuò)增的局部環(huán)境:B細(xì)胞被CD40L激活后,大量上調(diào)共刺激分子(如CD58、CD83),這些分子與T細(xì)胞表面受體結(jié)合,為T細(xì)胞提供必需的“第二信號(hào)”,促進(jìn)其增殖與存活。
同時(shí),B細(xì)胞釋放出一系列趨化因子(如CCL17、CCL22),進(jìn)一步吸引并聚集潛在的抗腫瘤T細(xì)胞。
提升TIL細(xì)胞產(chǎn)品的質(zhì)量:研究顯示,經(jīng)過(guò)B細(xì)胞激活輔助擴(kuò)增的TIL細(xì)胞,具有更多年輕表型(CD39- CD69-),這類T細(xì)胞被證明在體內(nèi)更具持久性和抗腫瘤活性。
更重要的是,TCR測(cè)序發(fā)現(xiàn),新抗原特異性克隆頻次明顯增加,意味著治療后能更精準(zhǔn)識(shí)別和殺傷腫瘤細(xì)胞。
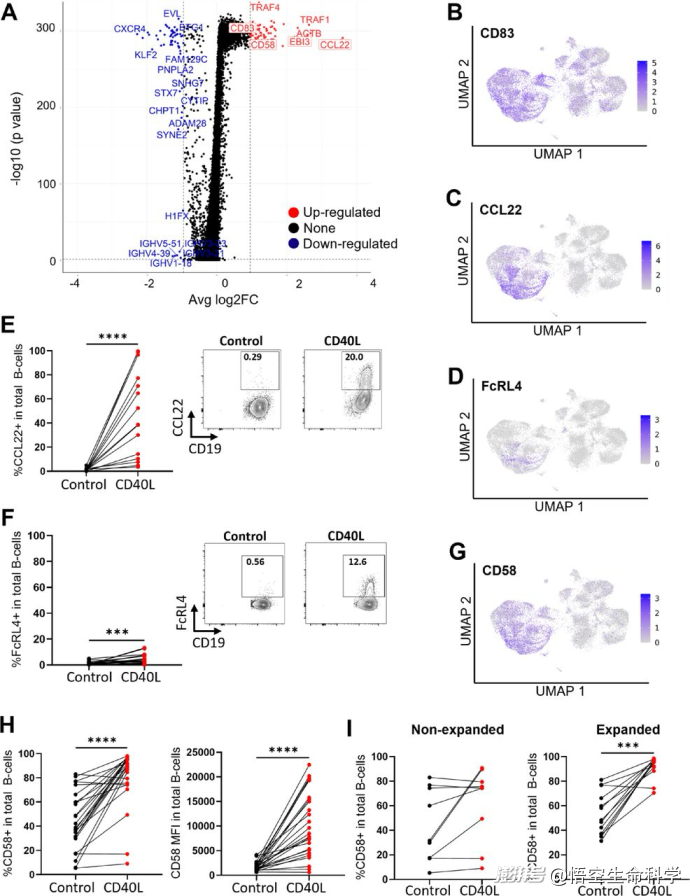
CD40L誘導(dǎo)黑色素瘤浸潤(rùn)B細(xì)胞的基因表達(dá)變化。黑色素瘤消化液在標(biāo)準(zhǔn)TIL(對(duì)照)或CD40L補(bǔ)充培養(yǎng)基中培養(yǎng)48小時(shí)(n=14個(gè)樣本,7名患者)
這一切意味著什么?
不僅TIL擴(kuò)增成功率翻倍,治療所用細(xì)胞的質(zhì)量也更好,治療后的持久反應(yīng)率、完全緩解率有望進(jìn)一步提升。
對(duì)于過(guò)去TIL擴(kuò)增失敗、無(wú)緣接受治療的患者,這一技術(shù)改進(jìn)也可能打破門檻,讓更多人受益。
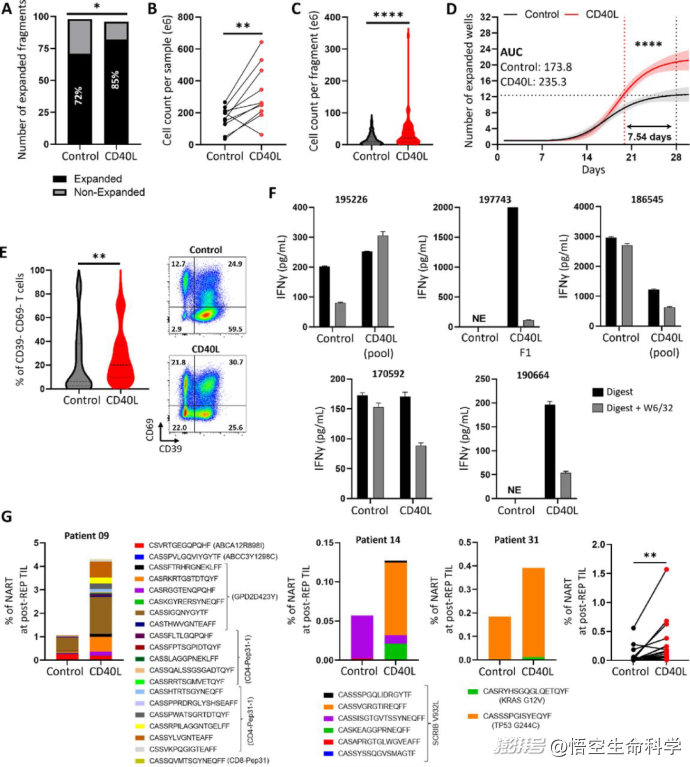
CD40L增強(qiáng)了NSCLC TIL的擴(kuò)張,并增加了新抗原反應(yīng)性T細(xì)胞的頻率
05 未來(lái)免疫療法:不止是強(qiáng)化單兵,而是激活全軍
在免疫治療的戰(zhàn)場(chǎng)上,單打獨(dú)斗的時(shí)代正在過(guò)去。
哈佛醫(yī)學(xué)院附屬達(dá)納-法伯癌癥研究院的這項(xiàng)研究提醒我們,真正高效持久的抗癌力量,來(lái)自細(xì)胞與細(xì)胞之間的協(xié)作與動(dòng)員。
B細(xì)胞不再是邊緣角色,而是TIL擴(kuò)增成功、療效增強(qiáng)的關(guān)鍵助力。
通過(guò)精準(zhǔn)激活B細(xì)胞這條新通路,科學(xué)家不僅提升了治療成功率,更重新繪制了免疫療法的戰(zhàn)略版圖。
未來(lái),當(dāng)更多類似的微創(chuàng)新被不斷發(fā)現(xiàn)與應(yīng)用,癌癥免疫治療或許將迎來(lái)一場(chǎng)真正意義上的質(zhì)變——
不只是延長(zhǎng)生命,更是賦予更多患者徹底逆轉(zhuǎn)命運(yùn)的可能。
本文為澎湃號(hào)作者或機(jī)構(gòu)在澎湃新聞上傳并發(fā)布,僅代表該作者或機(jī)構(gòu)觀點(diǎn),不代表澎湃新聞的觀點(diǎn)或立場(chǎng),澎湃新聞僅提供信息發(fā)布平臺(tái)。申請(qǐng)澎湃號(hào)請(qǐng)用電腦訪問http://renzheng.thepaper.cn。





- 報(bào)料熱線: 021-962866
- 報(bào)料郵箱: news@thepaper.cn
滬公網(wǎng)安備31010602000299號(hào)
互聯(lián)網(wǎng)新聞信息服務(wù)許可證:31120170006
增值電信業(yè)務(wù)經(jīng)營(yíng)許可證:滬B2-2017116
? 2014-2025 上海東方報(bào)業(yè)有限公司




