- +1
讓脊梁不再怕受傷
【編者按】在上海市科學技術委員會資助(項目編號:22DZ2304300)下,澎湃新聞聯合《世界科學》對獲得國家及上海市科技獎勵的獲獎成果進行科普化報道。
本篇報道圍繞2022年度上海市科學技術獎自然科學一等獎項目“脊髓損傷分子病理與修復機制”展開。該項目由同濟大學附屬同濟醫院教授、主任醫師程黎明主持完成。

同濟大學附屬同濟醫院骨科脊柱神經康復團隊
骨頭骨折可以通過打石膏等方式修復,但若是骨髓中的神經組織損傷了呢?
尤其是,負責“上傳下達”的信號“大動脈”——脊髓受傷了呢?只能癱瘓?
國家重點研發計劃首席科學家、同濟大學醫學與生命學部副主任、同濟大學脊柱脊髓損傷教育部重點實驗室主任、教授程黎明一直聚焦這一難題的攻關。
在接受澎湃科技專訪時,他說:“(脊髓損傷)就像路邊的電線桿倒了,把電線桿扶起來很容易,但要把斷了的電線接上,卻要花一番功夫。”他帶領團隊,創立了脊柱脊髓損傷全過程康復新策略及再生康復新體系。
程黎明主持完成的“脊髓損傷分子病理與修復機制”項目此前獲得2022年度上海市科學技術獎自然科學獎一等獎。
他帶領的研究團隊發現,小膠質細胞極有可能成為脊髓損傷修復的新靶點。他們通過醫工交叉,改良了促進修復的材料,并開展了國家衛健委批準的唯一一項人源性神經干細胞移植治療脊髓損傷的臨床研究。
病理如“黑箱”,如何找到脊髓損傷修復的關鍵靶點?
脊髓損傷(Spinal Cord Injury,SCI)的再生修復一直是再生醫學領域的熱點和難點,目前臨床上仍缺乏有效的治療及康復方法。SCI具有發病率高、治療費用高、致殘率高、發病年齡低等特點。《中國脊髓損傷者生活質量及疾病負擔調研報告2023版》顯示,根據既往研究數據,中國現存脊髓損傷患者374萬人,每年新增脊髓損傷患者約9萬人。
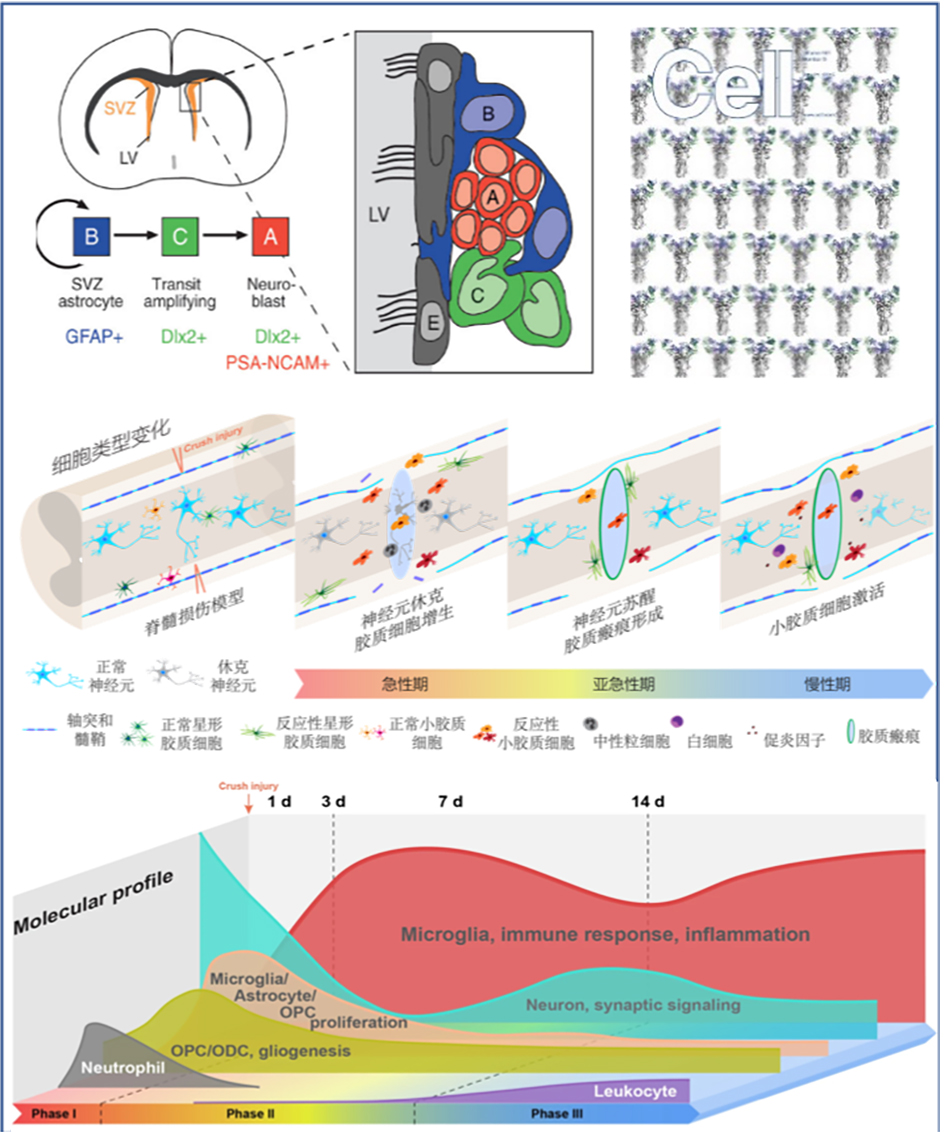
在Cell和STTT雜志上發表研究論文揭示脊髓損傷分子病理機制
脊髓損傷后神經功能的恢復取決于神經環路的完整性和可塑性,神經元軸突的斷裂和神經元的死亡會導致神經回路功能紊亂,因此,神經環路的可塑性是神經功能恢復的基礎。
然而,脊髓損傷后內源性神經干細胞和免疫細胞被大量激活,病理進程異常復雜,這使得神經環路的重塑異常困難,程黎明說,“包括脊髓在內的中樞神經系統(CNS)損傷通常會導致感覺、運動和自主神經功能的永久性損害,目前為止仍沒有有效的治療方法,SCI的病理機制猶如一個‘黑箱’,至今仍不完全清楚。”此外,不同類型細胞在SCI中的作用,如免疫細胞、星形膠質細胞、小膠質細胞等,也存在爭議。
程黎明表示,既往大量研究表明其治療難點在于如何改善損傷區的微環境,從而實現神經再生和功能重塑。“且目前關于脊髓損傷后損傷微環境的知識也相當有限,詳細了解這些過程可能有助于開發針對不同病理過程的最優治療方法。”
依托“脊柱脊髓損傷再生修復”教育部重點實驗室,在國家重點研發計劃、國家自然科學基金國際(地區)合作項目的支持下,程黎明開始了他的研究。
近年研究發現,中間神經元可能為近端和遠端神經元提供橋梁并形成新的神經環路,已成為脊髓損傷修復的研究重點。而這些關鍵的中間神經元可能來自脊髓原始中間神經元、移植的干細胞,或內源性神經干細胞分化出來的神經元、星形膠質細胞和少突膠質細胞。
程黎明帶領的研究團隊對雄性和雌性成年小鼠,在損傷后不同時間點未受傷和受傷的脊髓組織進行了群體測序(39個組織樣本)和單細胞測序(59558個細胞)綜合分析。數據揭示了發生在神經元、小膠質細胞、星形膠質細胞、內皮細胞等脊髓組織主要細胞類型的大多數分子病理動態變化。
研究數據表明:小膠質細胞和星形膠質細胞在未受傷的脊髓中似乎已有多種亞型,這些亞型在損傷后迅速發生表型轉變。而小膠質細胞的激活有兩個階段:第一階段在損傷早期激活,7天后有所恢復;第二階段在損傷后 14 天再次激活,這與神經元的繼發性損傷相吻合。有趣的是,雖然其他很多細胞類型的變化往往會最終恢復到未受傷狀態,但小膠質細胞似乎會永久地切換到不同的轉錄狀態,從而導致脊髓免疫微環境發生更長期的變化。
同時,研究團隊發現,在成年小鼠脊髓損傷后,也檢測到具有促進新生小鼠再生的,小膠質細胞特征的小膠質細胞亞類,但與新生小鼠相比,其基因表達存在細微差異。改變這些細微差異或許有助于脊髓修復。
“這也就意味著,也許小膠質細胞極有可能成為脊髓損傷修復的新靶點。”程黎明說道。

程黎明教授
尋找點亮“生命之樹”的方法
問題的另一個關鍵是如何點亮這些關鍵細胞,以促進神經元的再生和恢復。
找到合適的點亮細胞的材料很重要。程黎明解釋:“就像電影《阿凡達》里的‘生命之樹’,死去的生物與其相連,能獲得新生,我們就在找這樣的材料。”
在“醫工交叉”的大背景下,程黎明找到了同濟大學納米生物醫藥專家,合作研發了一種可生物降解,能調節損傷區免疫細胞分型,抑制炎癥反應的層狀雙氫氧化物(LDH)納米材料——LDH-NT3。
具體來說,該材料具有神經免疫雙調控功能,可顯著促進神經干細胞(NSCs)的遷移、神經分化,激活L-Ca2+通道并誘導產生動作電位。研究團隊提出一種脊髓修復策略:利用該材料激活特定靶點TGFBR2,并協同調控神經干細胞及小膠質細胞。
研究人員將LDH負載神經營養因子NT3后,形成納米復合體系LDH-NT3,并將其移植于小鼠的脊髓損傷區域,在損傷區可見新生的內源性神經干細胞和功能神經元,脊髓損傷小鼠的行為學和電生理評價顯著提高。程黎明表示,“LDH材料本來就具有促進神經再生的作用,而我們又將其改良,形成了更優良的LDH-NT3材料,結果顯示,新材料對小鼠的脊髓損傷修復效果比LDH更好。”
“我們還在做一系列準備工作。我不知道哪天能讓這項成果走向臨床,也許很快,也許要奮斗一生。但做科研就是這樣。”程黎明說道。

程黎明教授指導脊髓損傷患者進行康復訓練
2022年10月,程黎明與兩位脊髓移植患者進行了面對面談話。他們參與了程黎明主導、國家衛生健康委員會批準的干細胞臨床試驗項目——人源性神經干細胞移植治療脊髓損傷安全性與初步有效性評價臨床研究,該項目是截至成稿時國家衛健委批準的唯一一項人源性神經干細胞移植治療脊髓損傷的臨床研究。兩位受試者在經過康復治療,以及干細胞治療后,脊髓恢復情況得到好轉。
“知識的海洋無窮無盡。我和我的團隊能發現脊髓治療的一點奧秘已經很幸運了。作為一名臨床醫生,滿足還未滿足的臨床需求是我最大的心愿,所以未來我的工作重點將繼續聚焦相關基礎研究,并加快實現已有成果的臨床轉化。”程黎明說道。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業有限公司




