- +1
科濟藥業(yè)CAR-T療法獲批:國內第五款,價格未披露,華東醫(yī)藥是合作方
又一款國產CAR-T療法在國內獲批。
3月1日,CAR-T細胞療法公司科濟藥業(yè)(2171.HK)對外宣布,國家藥品監(jiān)督管理局已經正式批準澤沃基奧侖賽注射液的新藥上市申請,用于治療復發(fā)或難治性多發(fā)性骨髓瘤成人患者,既往經過至少3線治療后進展(至少使用過一種蛋白酶體抑制劑及免疫調節(jié)劑)。
澤沃基奧侖賽注射液是一款靶向BCMA的自體CAR-T產品,這是繼復星凱特的阿基侖賽注射液,藥明巨諾(02126.HK)的瑞基奧侖賽注射液、信達生物(1801.HK)與馴鹿生物的伊基奧侖賽注射液以及合源生物的納基奧侖賽注射液之后,國內獲批的第五款CAR-T療法。
科濟藥業(yè)首款商業(yè)化產品:價格未披露,華東醫(yī)藥是合作方
科濟藥業(yè)成立于2014年,專注于治療血液惡性腫瘤和實體瘤的創(chuàng)新CAR-T細胞療法,2021年6月在港股上市。根據(jù)2023半年報,科濟藥業(yè)擁有十余個在研產品,此次澤沃基奧侖賽注射液走在最前面,也是該公司獲批的第一款產品。科濟藥業(yè)創(chuàng)始人李宗海評價,在科濟成立十年之際,澤沃基奧侖賽注射液的成功獲批上市是公司發(fā)展歷程中的重要里程碑。
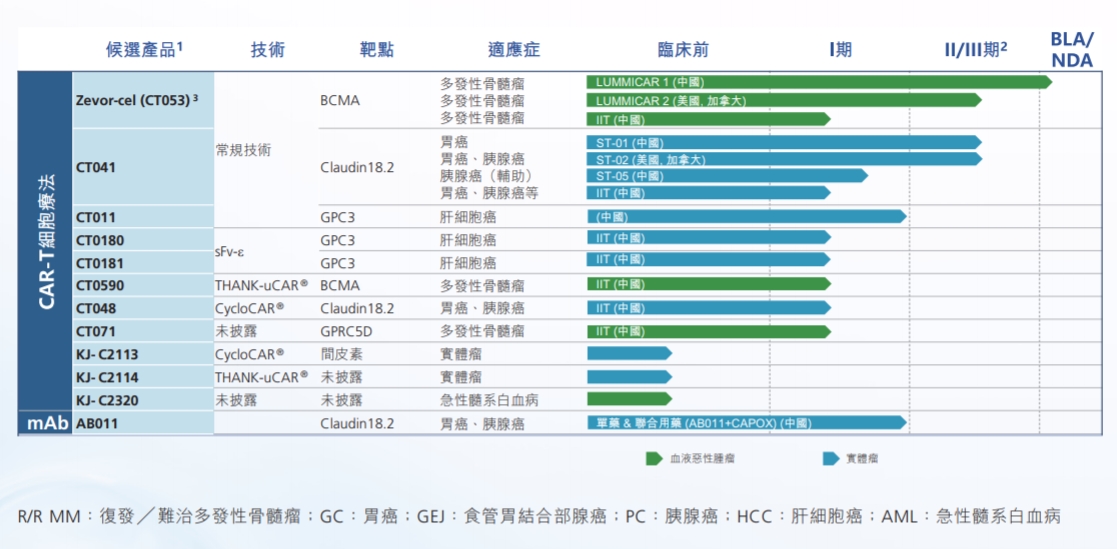
科濟藥業(yè)產品管線 來源:2023年半年報
CAR-T療法屬于細胞免疫療法,是在體外利用基因工程的方法修飾患者外周血T細胞,賦予T細胞靶向識別腫瘤細胞表面抗原的特性 ,經體外擴增培養(yǎng)后回輸?shù)交颊唧w內進行治療腫瘤的方法。簡單來說,就是利用人體免疫細胞抗癌,有“抗癌神藥”之稱。
CAR-T療法的價格普遍在百萬級別,此前合源生物的納基奧侖賽注射液被曝價格降至百萬以下,為99.9萬元。對于科濟藥業(yè)CAR-T療法的價格,澎湃新聞記者3月1日聯(lián)系了李宗海,他表示,目前價格還無法對外透露。
在商業(yè)化方面,科濟藥業(yè)的合作伙伴是華東醫(yī)藥(000963)。2023年1月16日,華東醫(yī)藥全資子公司華東醫(yī)藥(杭州)與科濟藥業(yè)控股有限公司的全資子公司愷興生命簽訂了產品獨家商業(yè)化合作協(xié)議。華東醫(yī)藥(杭州)獲得澤沃基奧侖賽注射液于中國大陸的獨家商業(yè)化權益。華東醫(yī)藥(杭州)向愷興生命支付2億元人民幣首付款,以及最高不超過10.25億元人民幣的注冊及銷售里程碑付款。
從獲批適應證來看,目前五款國產CAR-T療法的適應證不盡相同。復星凱特和藥明巨諾的CAR-T療法針對的是淋巴瘤,合源生物則針對白血病。科濟藥業(yè)和馴鹿生物的CAR-T療法針對的是多發(fā)性骨髓瘤。多發(fā)性骨髓瘤是一種難治性的惡性漿細胞疾病,約占所有血液腫瘤的10%。據(jù)Frost and Sullivan估計,2023年中國多發(fā)性骨髓瘤的患病人數(shù)大約為15.3萬人,新發(fā)病例數(shù)為2.32萬人,預計中國多發(fā)性骨髓瘤的患病人數(shù)于2030年將增長至26.63萬人。
CAR-T療法被FDA加黑框警告,科濟藥業(yè)等多方回應
CAR-T療法在腫瘤治療領域展現(xiàn)了強大的有效性,但安全性在最近幾個月受到外界關注。
2024年1月,美國食品藥品監(jiān)督管理局(FDA)直接向六款已上市的CAR-T療法發(fā)送安全標簽變更函,要求其添加T細胞癌癥風險的黑框警告。更早之前的2023年11月,F(xiàn)DA公告稱,將調查關于接受靶向BCMA或CD19自體CAR-T細胞免疫療法治療的患者出現(xiàn)T細胞惡性腫瘤(包括嵌合抗原受體CAR陽性淋巴瘤)的風險,已經確認目前批準的所有靶向BCMA和CD19的CAR-T療法都有該風險。
對此,國家藥監(jiān)局2月7日曾回應稱,考慮到CAR-T產品的特性,我國在批準四款CAR-T產品上市時,均已在說明書的“注意事項”中提示使用本品治療后,存在發(fā)生繼發(fā)性惡性腫瘤的可能性,并提示患者需終身監(jiān)測繼發(fā)性惡性腫瘤,在發(fā)現(xiàn)繼發(fā)性T細胞相關惡性腫瘤時聯(lián)系相關藥品上市許可持有人,以獲取進行相關樣本采集及檢測的指導。
對于自家產品的安全性,科濟藥業(yè)在官方通稿中提到,公司CAR-T療法的獲批是基于一項在中國進行的開放標簽、單臂、多中心二期的臨床試驗。根據(jù)2022年美國血液學會公布的試驗結果,產品表現(xiàn)出令人鼓舞的療效和良好的安全性。
此前李宗海在接受澎湃新聞記者采訪時表示,F(xiàn)DA此次的調查對做自身免疫性疾病的CAR-T公司可能沖擊更大一些,對做腫瘤適應證的公司影響相對較小。CAR-T的技術發(fā)展空間很大,將來還可以通過技術進一步改造提高產品的安全性,這也是企業(yè)可以做的方向。
科濟藥業(yè)還在推動CAR-T療法在海外市場的研發(fā),2023半年報提到,該藥在美國及加拿大進行的2期臨床試驗的入組正在進行中。不過,海外進展也有波折。
2023年12月,科濟藥業(yè)曾公告稱,科濟藥業(yè)在美國的子公司收到FDA通知,要求暫停CT053、CT041和CT071的臨床試驗,等待位于北卡羅來納州達勒姆的生產基地進行檢查后得出的結論。上述三款在研產品均為CAR-T療法,其中CT053就是此次在國內獲批的CAR-T療法。
2023年12月13日,科濟藥業(yè)向澎湃新聞記者表示,F(xiàn)DA本次并未針對公司臨床數(shù)據(jù)提出疑問,此次FDA的專業(yè)建議主要是因CMC(化學、制造和控制)相關問題,有些員工培訓等遺留問題需進行合規(guī)完善,并非針對工藝問題,這也讓公司有了明確的觀察項,幫助公司更有針對性地提升。公司有信心很快完成,會盡快將整改方案提供給FDA,后續(xù)保持交流,并落實整改。
截至3月1日收盤,科濟藥業(yè)跌0.6%,報收6.62港元,市值38.1億港元。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯(lián)網新聞信息服務許可證:31120170006
增值電信業(yè)務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業(yè)有限公司




