- +1
非酒精性脂肪性肝病領(lǐng)域現(xiàn)20億美元交易,百億藍(lán)海誰拔頭籌
2024開年以來,國內(nèi)醫(yī)藥領(lǐng)域已經(jīng)誕生多筆授權(quán)交易,其中一筆20億美元的交易誕生在非酒精性脂肪性肝病這一百億藍(lán)海市場。
1月3日,勃林格殷格翰宣布,攜手蘇州瑞博生物技術(shù)股份有限公司及瑞博國際研發(fā)中心(以下簡稱“瑞博”)共同開發(fā)治療非酒精性或代謝功能障礙相關(guān)脂肪性肝炎的小核酸創(chuàng)新療法。
根據(jù)雙方合作條款,瑞博除了將收到一筆預(yù)付款外,在此次多靶點合作項目中,瑞博將有權(quán)獲得基于開展臨床研究、藥物注冊和商業(yè)成功等里程碑付款以及上市產(chǎn)品的階梯式銷售提成,總交易金額超過20億美元。
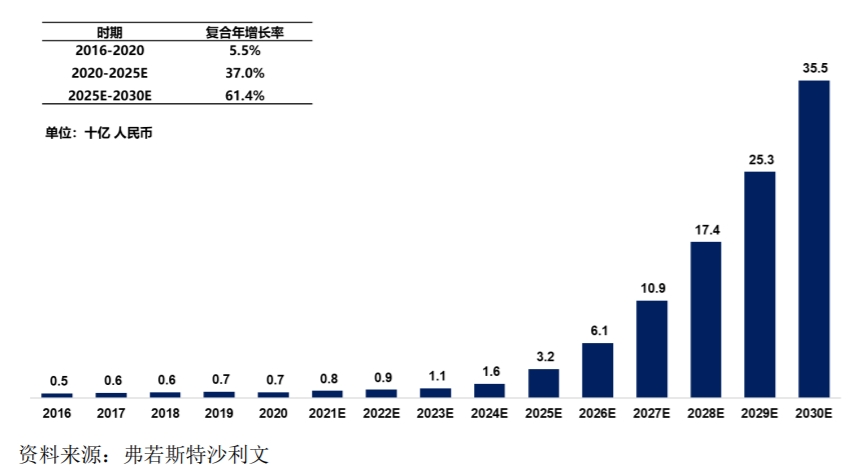
中國非酒精性脂肪性肝病市場規(guī)模 來源:派格生物2021年招股書
上述交易的一大看點是圍繞非酒精性脂肪性肝病這一疾病領(lǐng)域。據(jù)弗若斯特沙利文報告,2020年全球非酒精性脂肪性肝病相關(guān)藥物的市場規(guī)模僅19億美元,但預(yù)計將于2030年達(dá)到322億美元,而中國市場將達(dá)到355億元。
非酒精性脂肪性肝病發(fā)病機制復(fù)雜,目前全球已獲批用于直接治療該病的藥物有限,市場競爭還是一片藍(lán)海。在國內(nèi),除了被跨國藥企看中的瑞博,包括中國生物制藥(1177.HK)、歌禮(1672.HK)、眾生藥業(yè)(002317.SZ)、微芯生物(688321.SH)、天士力(600535.SH)、雙鷺?biāo)帢I(yè)(002038.SZ)等在內(nèi)的多家上市公司也均有布局。
值得一提的是,2023年以來大火的GLP-1類藥物除了在糖尿病、肥胖等方面的效果,在非酒精性脂肪性肝病領(lǐng)域的潛能也備受期待。
非酒精性脂肪性肝病患者不斷增加,為何相關(guān)藥物研發(fā)難?
根據(jù)國家藥監(jiān)局藥審中心2019年3月公布的《非酒精性脂肪性肝炎治療藥物臨床試驗技術(shù)指導(dǎo)原則(試行)》,非酒精性脂肪性肝病(NAFLD)是一種與胰島素抵抗和遺傳易感密切相關(guān)的代謝應(yīng)激性肝臟損傷,疾病譜包括非酒精性脂肪性肝炎(NASH)等。有文獻(xiàn)報道,NAFLD全球患病率為25.24%,且逐年增加。其中NASH是導(dǎo)致肝硬化的主要原因之一,NASH患者10年至15年內(nèi)肝硬化發(fā)生率高達(dá)15%至25%。
據(jù)弗若斯特沙利文報告,全球非酒精性脂肪性肝病患者數(shù)量呈上升趨勢,2020年達(dá)到17.6億,而全球 NASH患病人數(shù)從2016年的3.1億人已上升到2020年的3.5億,預(yù)計2030年將達(dá)到4.9億人。中國方面,非酒精性脂肪性肝病患病人數(shù)2020年已接近2億人,在人口老齡化及肥胖、糖尿病等疾病因素的作用下,預(yù)計2030年達(dá)到2.8億人。2020年中國NASH患病人數(shù)達(dá)到3870萬人,預(yù)計2030年將達(dá)到5550萬人。
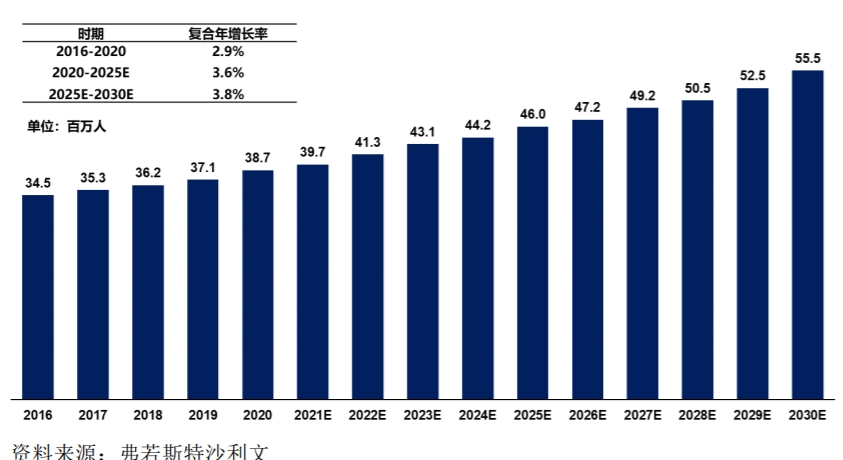
中國NASH流行病學(xué)分析 來源:派格生物2021年招股書
與患者人數(shù)攀升形成對比的是,治療NASH在內(nèi)的非酒精性脂肪性肝病的特效藥極少。光大證券2023年10月的一份研報指出,目前全球僅一款藥物Saroglitazar在印度獲批治療NASH,美國食品藥品監(jiān)督管理局(FDA)至今尚未批準(zhǔn)任何NASH治療藥物上市。患者現(xiàn)有的康復(fù)手段僅是改善飲食習(xí)慣與鍛煉,并通過一些針對其他高度相關(guān)的代謝病藥物,如降糖藥、降血壓藥、降脂藥或治療肝損藥物等進(jìn)行間接控制。
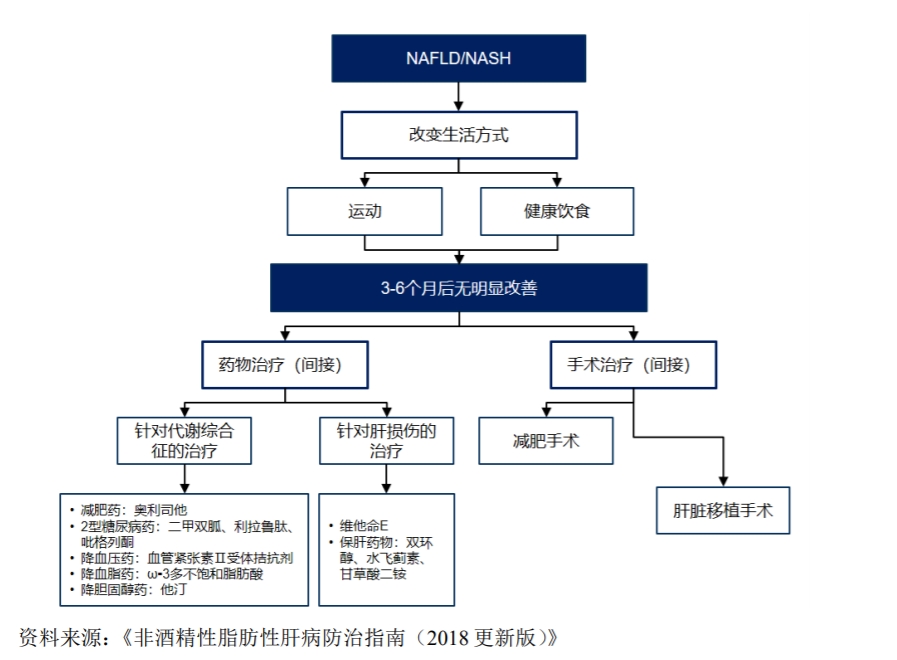
目前的非酒精性脂肪性肝病治療路徑 來源:派格生物2021年招股書
上述研報指出,NASH相關(guān)藥物研發(fā)至今已接近40年,但多家國際藥企巨頭在此折戟沉沙,主要原因是藥物無效或副作用大。NASH藥物開發(fā)的一波多折,主要是因為NASH發(fā)病機理復(fù)雜,且肝部是代謝中樞,缺乏有效且安全的靶點;FDA對臨床終點的認(rèn)定較嚴(yán)格,且需要肝穿刺的病理學(xué)評價。
《臨床肝膽病雜志》2021年8月發(fā)布的一篇文章指出,目前NASH新藥臨床試驗失敗的主要原因是,僅一小部分患者對治療有反應(yīng),而且還缺少已證實可以減少纖維化的藥物,而纖維化可能是有意義的有效治療終點。此外,NASH試驗中的安慰劑效應(yīng)約為19%,這可能與對照組生活方式干預(yù)的效果有關(guān)。
多家國內(nèi)上市藥企布局NASH領(lǐng)域,進(jìn)展如何?
盡管NASH研發(fā)存在諸多難點,但面對未被滿足的需求和百億藍(lán)海市場,國內(nèi)外已經(jīng)有不少藥企加碼布局。
2023年9月,美國Madrigal Pharmaceuticals公司宣布,在研NASH療法Resmetirom的新藥申請獲得FDA授予的優(yōu)先審評資格,預(yù)計在2024年3月14日之前獲得審評結(jié)果。業(yè)內(nèi)普遍認(rèn)為,該藥有望成為首款獲得FDA批準(zhǔn)的NASH療法。
國內(nèi)布局NASH領(lǐng)域的企業(yè)不在少數(shù),目前大都處于早期階段。從公開資料來看,走在前面的是中國生物制藥的拉尼蘭諾。
拉尼蘭諾屬于泛PPAR激動劑,是一種口服小分子藥物。2023半年報提到,2023年3月,該藥向CDE遞交臨床試驗申請并獲得受理;7月,拉尼蘭諾被納入突破性治療品種名單。目前該產(chǎn)品正在全球進(jìn)行三期臨床試驗,是中國第一個進(jìn)入臨床三期的NASH口服藥物,有望填補中國NASH市場空白。
同樣屬于PPAR激動劑的還有微芯生物的西格列他鈉,該藥在2021年獲批用于治療2型糖尿病,目前也在推動NASH適應(yīng)證的臨床進(jìn)展。2023年11月13日,微芯生物披露的投資者關(guān)系記錄表提到,2023年8月,西格列他鈉單藥治療NASH的 II 期臨床試驗完成入組, 給藥后觀察期為18周,臨床數(shù)據(jù)讀出的時間,快的話是2024年一季度左右,還要看實際的進(jìn)展。

歌禮制藥NASH研發(fā)情況 來源:2023半年報
歌禮擁有三款在研NASH藥物,均處于二期臨床研究階段。1月2日,歌禮宣布了NASH藥物ASC41片用于治療經(jīng)肝穿活檢證實的NASH患者的52周Ⅱ期臨床試驗取得積極期中結(jié)果。歌禮制藥介紹,該藥屬于甲狀腺激素受體β激動劑,具有肝臟靶向性和高度的THRβ選擇性。
眾生藥業(yè)的代謝性疾病研發(fā)管線也包括NASH藥物,目前也處于二期研究階段。2023年12月15日披露的一份投資者關(guān)系記錄表顯示, ZSP1601片是國內(nèi)第一個獲批臨床擬用于NASH治療的小分子創(chuàng)新藥物,目前正在開展2b期臨床研究,已于6月份完成首例入組。
2023年9月,天士力曾公告稱,控股子公司天士力生物收到B1344注射液用于NASH的《藥物臨床試驗批準(zhǔn)通知書》。天士力介紹,該藥是由天士力生物研究開發(fā)的用于治療二型糖尿病和NASH的創(chuàng)新生物藥。天士力生物于2022年1月收到FDA同意B1344注射液用于NASH進(jìn)行臨床試驗的函,已經(jīng)完成1a期臨床試驗受試者入組。
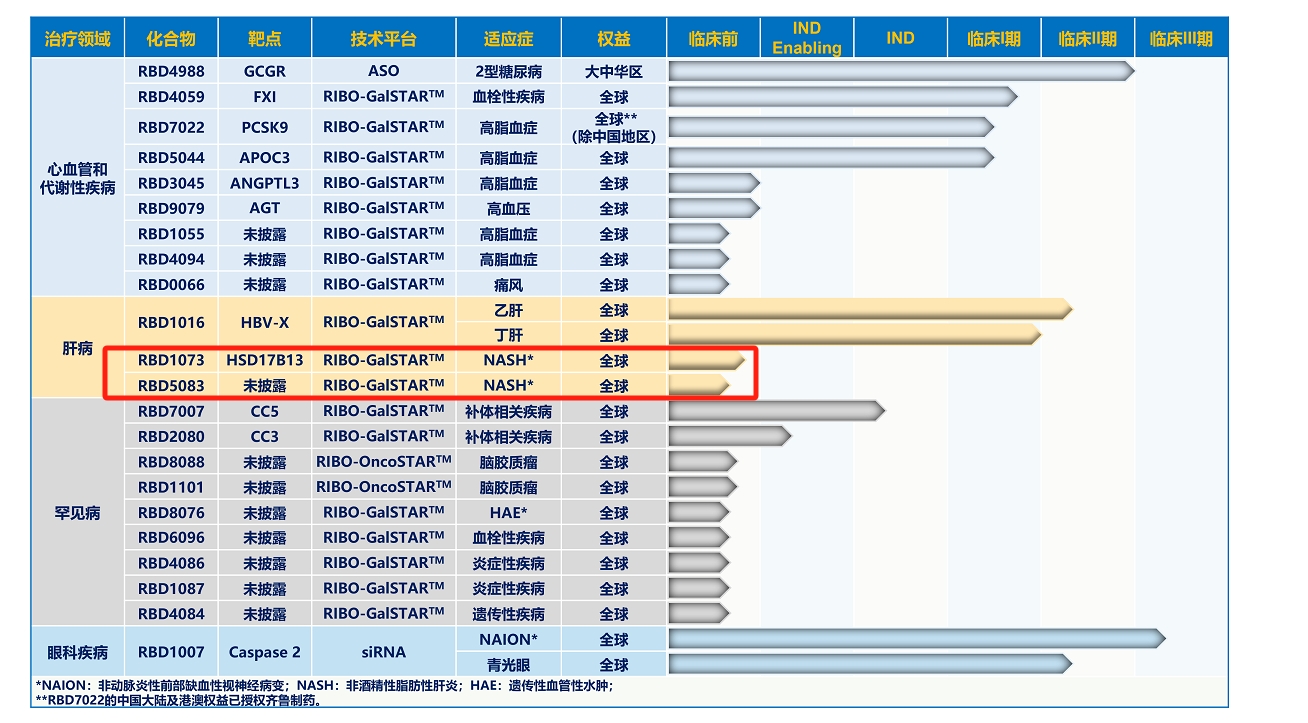
瑞博生物研發(fā)管線 來源:企業(yè)官網(wǎng)
勃林格殷格翰此次選擇合作的瑞博,根據(jù)其官網(wǎng)披露的產(chǎn)品管線,目前該公司有兩款NASH藥物,均處于臨床前研究階段。雙鷺?biāo)帢I(yè)2022年報提到,公司在美國設(shè)立DIAPIN THERAPEUTICS, LLC.合資公司,與密西根大學(xué)等方面合作,共同開發(fā)新型抗糖尿病及NASH化合物Diapin及心腦血管治療領(lǐng)域原創(chuàng)藥物。2023年11月2日披露的調(diào)研信息提到,Diapin也處于臨床前階段。
以“減肥藥”標(biāo)簽在全球大火的GLP-1類藥物在NASH領(lǐng)域潛力也備受關(guān)注,如“GLP-1雙雄”之一的禮來就曾提到,Tirzepatide對于肥胖或超重伴有射血分?jǐn)?shù)保留的心力衰竭、阻塞性睡眠呼吸暫停和NASH患者的潛在治療在研究中。
國內(nèi)藥企方面,華東醫(yī)藥(000963.SZ)擁有減肥適應(yīng)證的GLP-1類藥物。該公司在2023三季報提到,未來,公司將繼續(xù)探索GLP-1相關(guān)靶點的創(chuàng)新項目,拓展NASH等相關(guān)適應(yīng)證研發(fā)工作。
信達(dá)生物(1801.HK)擁有在研的GLP-1/GCGR雙重激動劑瑪仕度肽,2023年10月30日,該公司披露的最新研究數(shù)據(jù)顯示,瑪仕度肽高劑量9mg在中國肥胖受試者中的二期臨床研究繼24周主要研究終點達(dá)成后,完成48周治療期,減重療效顯著,安全性優(yōu)異,并展現(xiàn)多項代謝獲益,顯著降低了肥胖受試者的肝脂肪等。
成立于2008年5月的派格生物曾沖刺科創(chuàng)板未果,根據(jù)當(dāng)時披露的招股書,該公司的研發(fā)管線也覆蓋NASH,其中PB-718針對非酒精性脂肪性肝病處于美國臨床一期階段。PB-718也是一款GLP-1受體和胰高血糖素受體雙靶點激動劑組合物。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯(lián)網(wǎng)新聞信息服務(wù)許可證:31120170006
增值電信業(yè)務(wù)經(jīng)營許可證:滬B2-2017116
? 2014-2025 上海東方報業(yè)有限公司




