- +1
張文宏點評諾獎:mRNA技術(shù)落地是人類文明史上的又一次“盜火”
2023年10月2日下午5點45分,2023年諾貝爾生理學(xué)或醫(yī)學(xué)獎花落卡塔林·卡里科(Katalin Karikó)和德魯·維斯曼(Drew Weissman),他們因為研發(fā)的mRNA技術(shù),推動COVID-19 的 mRNA 疫苗發(fā)展而獲獎。

2023年諾貝爾生理學(xué)或醫(yī)學(xué)獎花落卡塔林·卡里科(Katalin Karikó)和德魯·維斯曼(Drew Weissman)。圖片來源:“華山感染”微信公眾號
如果沒有新冠疫情大暴發(fā),該技術(shù)在人類的應(yīng)用可能還要等待更久時間。因為這個mRNA疫苗技術(shù)原本一直聚焦在腫瘤的治療性疫苗研發(fā),該技術(shù)在短期內(nèi)就能研發(fā)各種不同于正常人體細胞的腫瘤細胞新抗原,進而誘發(fā)強烈的獲得性免疫反應(yīng)以期來治療腫瘤。
讓我們一起通過這篇文章了解新冠mRNA疫苗的研發(fā)始末,并了解卡塔林·卡里科和德魯·維斯曼在此中的卓越貢獻!
一、mRNA技術(shù)起源于科學(xué)家對人類基因的深入認知
1944年,洛克菲勒研究院的埃弗里等提出脫氧核糖核酸(DNA)是遺傳的物質(zhì)基礎(chǔ)。1953年,沃森和克里克發(fā)現(xiàn)了DNA雙螺旋的結(jié)構(gòu),開啟了分子生物學(xué)時代,使遺傳的研究深入到分子層次,“生命之謎”被打開,使人們清楚地了解遺傳信息的構(gòu)成和傳遞的途徑。

埃弗里提出DNA是遺傳的物質(zhì)基礎(chǔ)。圖片來源:“華山感染”微信公眾號
1961年,在加州理工學(xué)院的一個實驗室,科學(xué)家首次成功提取到mRNA。之后對其功能和生物學(xué)行為進行了充分的研究。科學(xué)界發(fā)現(xiàn),在DNA和蛋白質(zhì)之間有個“中間人”,負責(zé)傳遞信息,mRNA正是這個“中間人”。

沃森和克里克發(fā)現(xiàn)了DNA雙螺旋的結(jié)構(gòu)。圖片來源:“華山感染”微信公眾號
mRNA(Messenger RNA),又稱為信使RNA,是由DNA的一條鏈作為模板轉(zhuǎn)錄而來的,攜帶遺傳信息的能指導(dǎo)蛋白質(zhì)合成的一類單鏈RNA。通俗來講,mRNA復(fù)制了細胞核中雙鏈DNA的一條鏈的遺傳信息,隨即離開細胞核在細胞質(zhì)中生成蛋白質(zhì)。在細胞質(zhì)中,核糖體沿著mRNA移動,讀取其堿基序列,并翻譯成其相應(yīng)的氨基酸,最終形成蛋白質(zhì)。
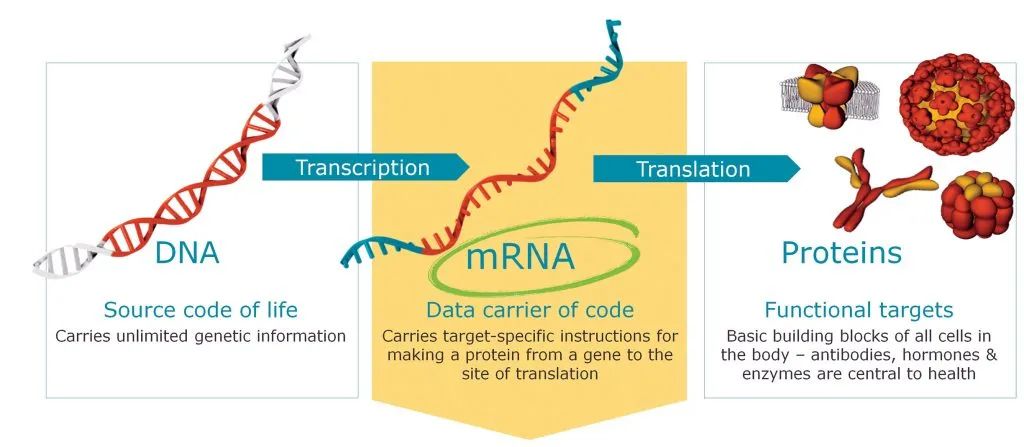
mRNA是由DNA的一條鏈作為模板轉(zhuǎn)錄而來,攜帶遺傳信息的能指導(dǎo)蛋白質(zhì)合成。圖片來源:“華山感染”微信公眾號
1990年,威斯康星大學(xué)Wolff等才首次報道肌內(nèi)注射mRNA到小鼠骨骼肌里,可以表達相應(yīng)蛋白質(zhì)并產(chǎn)生免疫反應(yīng)。這揭示了mRNA技術(shù)用于疫苗研究的可能性。2年后,又有研究者將編碼激素的mRNA,直接注射至小鼠大腦中,發(fā)現(xiàn)有緩解尿崩癥的作用。這說明mRNA具備成為治療性藥物的潛力。
mRNA疫苗的原理是是將編碼疾病特異性抗原的mRNA引入體內(nèi),利用宿主細胞的蛋白質(zhì)合成機制產(chǎn)生抗原,從而觸發(fā)免疫應(yīng)答,從而達到預(yù)防疾病作用。如果將人體比作一臺機器,那么數(shù)百萬種微小的蛋白質(zhì)便是維持機器運行的零部件,而mRNA則是制造零部件的總指揮。
也就是說mRNA序列注射到人體后,跳過體外合成蛋白質(zhì)的過程,直接在人體細胞內(nèi)生產(chǎn)病原體免疫表位的蛋白,對免疫系統(tǒng)進行了“戰(zhàn)前演習(xí)”,誘導(dǎo)識別病毒蛋白,從而產(chǎn)生對特定病原體的免疫記憶。當(dāng)真正病原體進入人體時,免疫細胞如同訓(xùn)練有素的軍人,快速識別病原體對其發(fā)動精準(zhǔn)攻擊。
二、mRNA技術(shù)用于疫苗研發(fā)的優(yōu)勢在哪里?
mRNA 疫苗技術(shù)路線相比更傳統(tǒng)疫苗具有三個重要的優(yōu)勢:快速、安全和高效。
1)mRNA疫苗最為顯而易見的優(yōu)勢就是快速。
和其他類別的疫苗相比,mRNA疫苗最大的優(yōu)勢在于一旦掌握病原體的基因序列,就可以很快研制出mRNA疫苗。mRNA疫苗技術(shù)因其在設(shè)計和構(gòu)建上的快速性和對病毒變異的高度應(yīng)變性,以及高效的通用性全合成生產(chǎn)工藝平臺, 易于標(biāo)準(zhǔn)化生產(chǎn)等技術(shù)優(yōu)勢決定了其生產(chǎn)環(huán)節(jié)及研發(fā)周期短,工藝相對簡單,疫苗能夠迅速量產(chǎn)。
新冠病毒基因序列發(fā)布42天后,科學(xué)家就設(shè)計出了第一款mRNA疫苗。同時如果病毒變異導(dǎo)致疫苗失效,mRNA技術(shù)也可以在很短的時間內(nèi)(1-2個月),改變mRNA序列,推出升級版的疫苗,以及時應(yīng)對病毒變異。
可以說,單憑快速這個技術(shù)優(yōu)勢,就滿足了傳染病暴發(fā)時快速研發(fā)和大規(guī)模、低成本、靈活性生產(chǎn)應(yīng)急性疫苗的技術(shù)要求,也是今后人類對抗新的傳染病暴發(fā)的有利手段。
2)mRNA的第二個優(yōu)勢是安全。為什么這么說?
(1)和傳統(tǒng)疫苗相比,從生產(chǎn)mRNA疫苗的過程來看,因為不需要大量培育活病毒,從而避免了疫苗生產(chǎn)過程中發(fā)生活病毒泄露的風(fēng)險。當(dāng)然,這個風(fēng)險是可以通過嚴(yán)格的GMP制度來控制預(yù)防的。
(2)也是和傳統(tǒng)疫苗相比,mRNA疫苗生產(chǎn)不會涉及感染性元素,因此不會發(fā)生由于類似脊髓灰質(zhì)炎疫苗曾經(jīng)發(fā)生過的種種感染風(fēng)險(點擊了解脊髓灰質(zhì)炎疫苗的歷史)。同樣,嚴(yán)格的GMP制度也能保證,或者說最大程度上降低這種風(fēng)險。
(3)對于各類核酸疫苗或者核酸藥物而言,mRNA片段理論上不會進入細胞核,因此也不存在穩(wěn)定整合到宿主細胞基因組的風(fēng)險,也就是說mRNA疫苗不會改變?nèi)梭w細胞中的DNA遺傳物質(zhì);相反,mRNA只是在人體細胞漿內(nèi)短暫停留,一旦生產(chǎn)出蛋白質(zhì),疫苗的RNA鏈就會被降解。
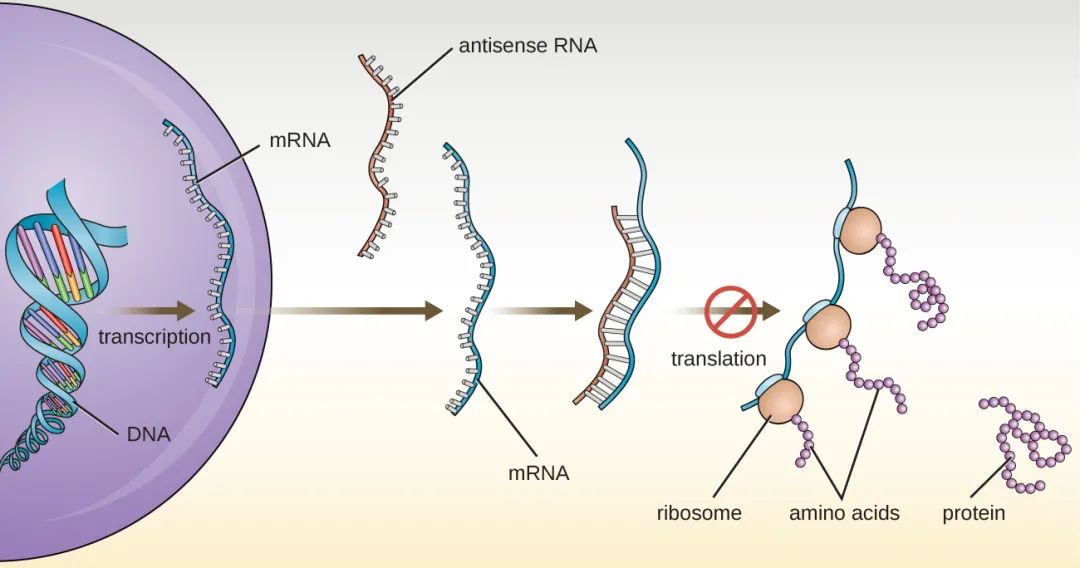
mRNA片段不進入細胞核,沒有穩(wěn)定整合到宿主細胞基因組的風(fēng)險。圖片來源:“華山感染”微信公眾號
(4)與傳統(tǒng)滅活疫苗相比,mRNA疫苗通常不需要額外的免疫佐劑,因此也就避免了佐劑造成不良反應(yīng)的風(fēng)險。
當(dāng)然,上述關(guān)于安全性的優(yōu)勢還有待于大規(guī)模的臨床運用中得到驗證,作為一種全新機制的疫苗,完善的上市后安全性監(jiān)測必不可少。
3)mRNA疫苗的第三個優(yōu)勢是高效。
傳統(tǒng)的滅活疫苗通過添加佐劑會影響體液免疫并增強抗體反應(yīng),但通常不能誘導(dǎo)細胞免疫。相比之下,基于基因的疫苗載體可以刺激體液免疫和細胞免疫,從而對傳染原提供更大的選擇壓力。此外,mRNA疫苗只要設(shè)計核酸并加以合成就可以,無需在體外表達蛋白,因此有條件只做針對數(shù)個病毒的組合疫苗,只要把靶基因串聯(lián)在一起就可能成功研制出組合疫苗,做到一苗多用,注射一種疫苗,可以同時預(yù)防多重疾病。比如將流感和新冠疫苗做在一起,多重病毒亞型做在一起,既方便又高效。
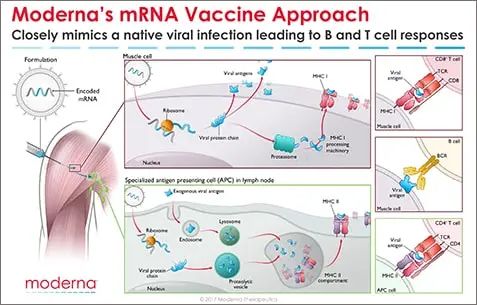
mRNA疫苗能誘導(dǎo)有效的MHC I類限制性CD8+以及MHC II類限制性CD4+T細胞反應(yīng)。圖片來源:“華山感染”微信公眾號
三、mRNA 技術(shù)突破了人類免疫系統(tǒng)對外來核酸的識別和消除
雖然,mRNA疫苗從理論上來看,具有這么多的優(yōu)勢,但為何直到新冠疫情暴發(fā)前,卻一直沒有任何一款mRNA疫苗問世呢?我們接著往下說。
長期以來,mRNA 作為疫苗的研究,因為受到分子的不穩(wěn)定性、免疫刺激不足和mRNA 遞送時的低表達水平的阻礙而進展緩慢。幸好科學(xué)家們沒有因此放棄,經(jīng)過20多年的時間,將上述難題逐一攻克了。
對于mRNA分子的不穩(wěn)定性,這個問題是最早被搞定的。科學(xué)家們認識到,RNA之所以不穩(wěn)定,是因為我們的環(huán)境中存在大量可以分解RNA的酶RNase,只要防止接觸RNase,或者通過試劑消除容器中的RNase,RNA 反而是一種相對穩(wěn)定的物質(zhì)。并且可以以凍干形式在環(huán)境溫度下長期儲存,極大地促進了分配和儲存 。
第二個難題是不能產(chǎn)生足夠的免疫反應(yīng),這個問題是最致命的,如果解決不好,mRNA疫苗的研發(fā)就會前功盡棄。
科學(xué)家們將最初在實驗室設(shè)計合成得到的mRNA疫苗進行動物實驗時,發(fā)現(xiàn)這些mRNA在小鼠身上不能產(chǎn)生任何設(shè)想中的免疫反應(yīng),也就是說疫苗沒有發(fā)揮作用。這是什么原因呢?經(jīng)過反復(fù)深入的研究,科學(xué)家們才發(fā)現(xiàn)原來小鼠免疫系統(tǒng)將mRNA當(dāng)做了外來物,直接發(fā)起免疫反應(yīng)將mRNA給清理掉。這對于之前信心滿滿的科學(xué)家是當(dāng)頭一棒。
來自匈牙利生物化學(xué)家賓夕法尼亞大學(xué)的卡塔林·卡里科(Katalin Karikó)致力于開發(fā)利用mRNA進行治療的方法。她與免疫學(xué)家德魯·維斯曼(Drew Weissman)就這個難題開展了卓有成效的合作,找到mRNA的“致命弱點”。并通過mRNA修飾技術(shù),成功解決了這一難題。
他們發(fā)現(xiàn)哺乳動物細胞RNA中的堿基經(jīng)常被化學(xué)修飾,而在試管內(nèi)轉(zhuǎn)錄的mRNA不是。他們想知道是否缺乏改變的堿基在試管內(nèi)轉(zhuǎn)錄的RNA可以解釋不必要的炎癥反應(yīng)。為了研究這一點,他們產(chǎn)生了不同的mRNA變體,每種變體的堿基都有獨特的化學(xué)變化,然后將它們傳遞給樹突細胞。結(jié)果是驚人的:當(dāng)mRNA中包含堿基修飾時,炎癥反應(yīng)幾乎消失。
他們證明,mRNA之所以能引起宿主的免疫反應(yīng),關(guān)鍵在于一種叫做尿嘧啶的核苷酸。如果能修改其核苷部分,創(chuàng)造一個假尿嘧啶代替原來成分,就能大大降低樹突狀細胞識別出該mRNA的可能性,從而躲避免疫應(yīng)答。這是我們對細胞如何識別不同形式的mRNA并對其做出反應(yīng)的理解的范式轉(zhuǎn)變。卡里科和維斯曼立即意識到他們的發(fā)現(xiàn)對使用mRNA作為治療手段具有深遠的意義。
他們的研究發(fā)表于2005年,比新冠疫苗的研發(fā)足足早了15年。這一難題的解決也就是卡里科和維斯曼此次榮獲諾貝爾生理學(xué)或醫(yī)學(xué)獎的原因。

卡里科和維斯曼通過mRNA修飾技術(shù)解決了mRNA被宿主固有免疫識別和清除的難題。圖片來源:“華山感染”微信公眾號
此外,另一個難題也有待解決。理論上mRNA無所不能,但很難進入臨床研究,很大一個原因是mRNA進入人體非常低效,也就是缺乏一種有效的載體幫助mRNA進入細胞。2015年科學(xué)家將mRNA制成微小脂肪粒,稱為脂質(zhì)納米顆粒(Lipid Nanoparticles, LNPs),以提高穩(wěn)定性并使其更容易進入細胞,顯著改善了mRNA疫苗的信息傳遞效率。
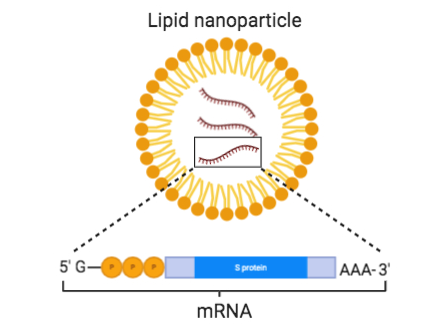
LNP顯著改善了mRNA疫苗的傳遞效率。圖片來源:“華山感染”微信公眾號
脂質(zhì)納米顆粒具有較好的生物相容性和生物降解性。納米藥物最顯著的特性是高表面積體積比,這實現(xiàn)了高效的藥物包裝。封裝的藥物受到保護,免于降解和免疫清除,并且由于有效的藥物包裝,可以大大降低給藥劑量。當(dāng)然,LNP還是有一定的反應(yīng)原性,可能會造成接種者大概100萬分之幾的比例出現(xiàn)嚴(yán)重的過敏癥狀,技術(shù)上有進一步改進的空間。
至此,mRNA疫苗卡脖子的難題被逐一突破,全新的mRNA疫苗呼之欲出。
四、為什么是新冠大暴發(fā)才促成mRNA技術(shù)的落地?
2020年新冠疫情暴發(fā),mRNA疫苗得以一戰(zhàn)成名。其實在新冠疫苗之前,大部分關(guān)于mRNA疫苗的早期工作都集中在癌癥方面。癌癥疫苗是治療性的,而不是預(yù)防性的,旨在針對腫瘤細胞優(yōu)先表達的腫瘤相關(guān)抗原,因此,刺激細胞介導(dǎo)的免疫反應(yīng),能夠減少腫瘤負擔(dān)。
目前針對癌癥領(lǐng)域的mRNA疫苗涉及的臨床試驗適應(yīng)癥包括了乳腺癌、非小細胞肺癌、黑色素瘤、多發(fā)性骨髓瘤等,其中也有多項臨床試驗已經(jīng)進入了Ⅱ期臨床研究階段。
同時,目前在針對感染病領(lǐng)域mRNA疫苗開展的臨床研究有很多,其中適應(yīng)癥包括了狂犬病、人偏肺病毒、寨卡病毒、巨細胞病毒和HIV等,其中針對HIV的多項臨床試驗已經(jīng)進入了Ⅱ期臨床研究階段。
除了在癌癥和傳染病方面,最近的動物研究結(jié)果表明,RNA疫苗還有可能用于預(yù)防或治療過敏和自身免疫性疾病。
如果沒有新冠疫情發(fā)生,上述關(guān)于mRNA疫苗的研究正在不急不慢地進行中,原本估計要出現(xiàn)獲批的RNA疫苗大概至少還需要5到7年的時間。
不過在新冠疫情中,前所未有的合作環(huán)境和政府投資徹底改變了一切,幾個月內(nèi)就通過有效性數(shù)據(jù)和大規(guī)模應(yīng)用為疫苗提供了概念性驗證。政府支持幫助制造商在風(fēng)險中擴大規(guī)模,同時獲取了第一批有效性數(shù)據(jù)。
2020年7月,III期臨床試驗開始。當(dāng)III期臨床研究完成,疫苗準(zhǔn)備提交監(jiān)管部門批準(zhǔn)時,企業(yè)就已經(jīng)開始大規(guī)模生產(chǎn)儲備。
2020年11月16日,Moderna公布了III期臨床數(shù)據(jù),30000名接種者中,疫苗有效率94.5%,重癥保護力100%。11 月 9 日,BioNTech的III 期臨床數(shù)據(jù)公布,mRNA 疫苗有效率超過 90%。
2020年12月,兩家公司的新冠mRNA疫苗先后在多國獲批上市。人類也隨之拉開了大規(guī)模疫苗接種的序幕。
Moderna和BioNTech的新冠mRNA疫苗先后在多國獲批上市。圖片來源:“華山感染”微信公眾號
美國國家過敏和傳染病研究所的安東尼?福奇和約翰?馬斯科拉曾經(jīng)在《自然免疫學(xué)評論》雜志上寫道:mRNA有可能成為一個快速靈活的疫苗平臺。由基因序列開始,幾周內(nèi)就可以生產(chǎn)出mRNA疫苗。
2020年新冠疫情暴發(fā),mRNA技術(shù)剛好準(zhǔn)備就緒,成就了一次天時地利的歷史巧合。經(jīng)過約40年的上下求索后,mRNA技術(shù)終于迎來全新篇章。從新冠疫苗起步,到癌癥治療,未來mRNA技術(shù)或許能夠逐步涉足更多疾病領(lǐng)域。

復(fù)旦大學(xué)附屬華山醫(yī)院感染科主任張文宏。圖片來源:“華山感染”微信公眾號
張文宏教授點評
mRNA疫苗技術(shù)落地是人類文明史上的又一次“盜火”,預(yù)示可能會帶來生物醫(yī)藥領(lǐng)域的巨變
人類識別外來病原體的核酸并誘導(dǎo)強烈的炎癥反應(yīng),通過炎癥反應(yīng)消除病原體是人類進化中形成的保護機制,可以有效識別各種蛋白和核酸。天然免疫細胞可以識別DNA或者RNA病毒的核酸, 進而誘發(fā)強烈的炎癥反應(yīng),同時對病毒抗原進行呈遞,誘導(dǎo)獲得性免疫,達到消除病原體的目的。這是人類在自然界生存數(shù)百萬年的免疫力密碼,但mRNA 疫苗注射后也會像病毒一樣,被人類的免疫系統(tǒng)識別,誘發(fā)炎癥反應(yīng),最終被迅速降解,就不能繼續(xù)表達疫苗靶蛋白,起到疫苗的作用了。mRNA疫苗技術(shù)的落地正好是繞過了人類數(shù)百萬年形成的核酸識別與炎癥反應(yīng),讓mRNA疫苗實現(xiàn)在體內(nèi)靶向分子的表達,這一技術(shù)落地是人類科學(xué)的又一次底層技術(shù)突破,會帶來我們難以預(yù)計的生物醫(yī)藥領(lǐng)域巨變。
從疫苗的發(fā)展史來看,就時間線上而言,減毒活疫苗和滅活疫苗最早來到科學(xué)舞臺上,是科學(xué)家針模擬人類感染病原體后產(chǎn)生免疫力的過程,來完成了一次與自然感染接近的過程,進而獲得了免疫力,比如天花病毒疫苗、水痘病毒疫苗、麻疹病毒疫苗都是屬于這一類,這些疫苗在人類歷史上消除傳染病流行立下了不滅的功勛。隨后是重組蛋白疫苗等組分疫苗問世,這一代的疫苗是通過模擬病毒一些重要蛋白而制作的靶向疫苗,人體針對這些病毒組分產(chǎn)生抗體和免疫反應(yīng),起到建立免疫力的作用,針對特定的組分產(chǎn)生的免疫力會更強,像乙肝疫苗就是這一類疫苗,目前我國2000年后出生的群體幾乎人人接種了乙肝疫苗,因此2000年以后出生的人口中,幾乎很少有人感染乙肝病毒了。mRNA屬于核酸疫苗,新冠疫情中首次用于人類對抗疾病,系通過直接注射mRNA在體內(nèi)表達特異性蛋白來保持持續(xù)的免疫應(yīng)答,建立很強的免疫力。由于在疫苗的制造工藝上不需要再進行蛋白的表達和純化,只要合成基因就可以了,對疫苗的制造工藝而言是一次極大的技術(shù)突破,用于應(yīng)對新冠這樣的突發(fā)傳染病,優(yōu)勢非常明顯。但更為重要的是這類技術(shù)的臨床應(yīng)用從此打開了一個新的天地。
人類文明從掌握用火的技術(shù)開始,自此人類的發(fā)展日新月異,從沃森發(fā)現(xiàn)DNA雙螺旋結(jié)構(gòu),繼而明白了基因復(fù)制和翻譯功能蛋白的秘密,直至這次通過mRNA 技術(shù)用于疫苗的研發(fā)和應(yīng)用,以及應(yīng)對大流行的成功,標(biāo)志著人類掌握了直接輸注核酸在體內(nèi)表達所需要的疫苗成分或者其他疾病治療所需要的蛋白組分,對于腫瘤性疾病、遺傳性疾病、免疫性疾病,將帶來極大的前景。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯(lián)網(wǎng)新聞信息服務(wù)許可證:31120170006
增值電信業(yè)務(wù)經(jīng)營許可證:滬B2-2017116
? 2014-2025 上海東方報業(yè)有限公司




