- +1
追問|20年來首款獲得FDA完全批準的阿爾茨海默病新藥上市
· FDA強調(diào),Leqembi 應(yīng)該從患有阿爾茨海默病輕度認知障礙或輕度癡呆階段的患者中開始使用。處方信息指出,在開始 Leqembi 治療之前應(yīng)進行 ApoE ε4 基因檢測,以了解發(fā)生淀粉樣蛋白相關(guān)成像異常的風(fēng)險。
·“它真正實現(xiàn)了阿爾茨海默病病理機制上根本性的干預(yù),對全世界阿爾茨海默病患者都有很大的意義。”
Leqembi由衛(wèi)材和渤健公司聯(lián)合開發(fā)。圖片來源:Clear Thoughts Foundation
當?shù)貢r間7月6日,美國食品藥品監(jiān)督管理局(FDA)宣布,完全批準阿爾茨海默病(AD)新藥Leqembi(通用名:Lecanemab)上市。這也是20年來首款獲得FDA完全批準的阿爾茨海默病新藥。
Leqembi由日本衛(wèi)材藥業(yè)(Eisai)和美國渤健公司(Biogen)聯(lián)合開發(fā),2023年1月,獲得FDA加速批準上市。此前的6月9日,F(xiàn)DA外周和中樞神經(jīng)系統(tǒng)藥物咨詢委員會(以下簡稱“FDA咨詢委員會”)以6-0投票贊成完全批準Leqembi的決定。
作為加速批準的上市后要求,F(xiàn)DA 要求申請人進行臨床試驗(通常稱為驗證性研究),以驗證 Leqembi 的預(yù)期臨床益處。其療效使用3 期隨機對照臨床試驗Study 301(CLARITY AD)進行評估,Leqembi展示了積極的治療效果。
“今天的批準首次驗證了一種針對阿爾茨海默病潛在疾病過程的藥物在這種毀滅性疾病中顯示出臨床益處。” FDA 藥物評價與研究中心神經(jīng)科學(xué)辦公室代理主任 特雷薩·布拉奇奧(Teresa Buracchio) 表示:“這項驗證性研究證實,它對于阿爾茨海默病患者來說是一種安全有效的治療方法。”
此次完全獲批對Leqembi未來的商業(yè)化意義重大,意味著美國醫(yī)療保險可以覆蓋該藥的適應(yīng)癥人群,即阿爾茨海默病輕度認知障礙或輕度癡呆階段的患者。(詳見澎湃科技報道:《阿爾茨海默病藥物L(fēng)eqembi有望獲美國FDA完全批準》)
至此,衛(wèi)材和渤健成功跨越了其早先研發(fā)的阿爾茨海默病新藥Aduhelm(通用名:Aducanumab)投下的陰影。由于兩項設(shè)計相同的臨床試驗未能取得一致結(jié)果,Aducanumab在FDA咨詢委員會一邊倒的反對聲中加速批準上市,美國醫(yī)療保險和醫(yī)療補貼服務(wù)中心(CMS)也決定限制其醫(yī)保覆蓋范圍,嚴格限制為僅用于參與臨床試驗的患者。
和Aducanumab一樣,Lecanemab也通過減少大腦中聚集的Aβ發(fā)揮療效。Lecanemab的成功上市可謂對AD發(fā)病機制的“Aβ級聯(lián)瀑布假說”的有力支持,也為靶向Aβ的AD新藥開發(fā)注入了一劑“強心針”。2022年11月29日,衛(wèi)材和渤健公布了CLARITY AD 3期關(guān)鍵臨床試驗數(shù)據(jù),證明了Lecanemab的積極療效。CLARITY AD研究是一項全球多中心、隨機雙盲、安慰劑對照、平行分組的驗證性3期研究,納入1795例AD源性輕度認知障礙或輕度AD受試者。
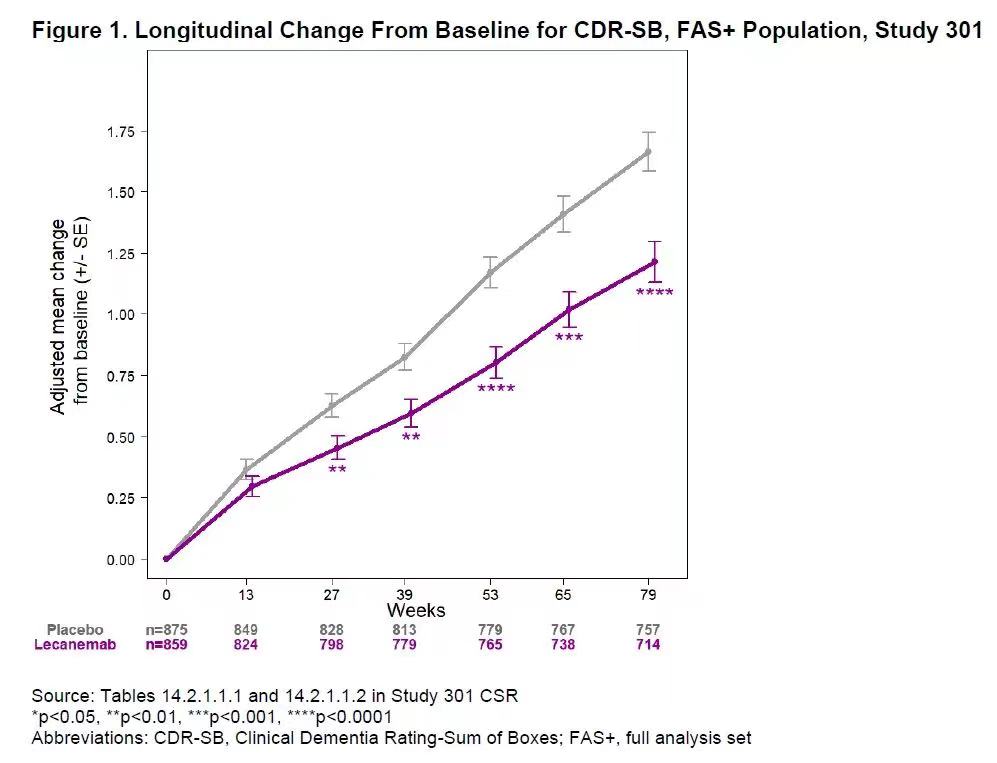
Lecanemab顯著減緩阿爾茨海默病患者認知和記憶功能下降的速度。圖片來源:FDA官網(wǎng)
研究結(jié)果顯示與安慰劑相比,使用Lecanemab治療18個月后,患者的認知和記憶功能下降的速度減慢了27%,并且在治療6個月時,用藥組和對照組就出現(xiàn)了統(tǒng)計學(xué)顯著差異。衛(wèi)材公司曾透露,根據(jù)模型推算,與標準治療相比,Lecanemab可以將早期AD患者進展為中度的時間推遲2-3年,但這一結(jié)果還需長期臨床試驗驗證。
在安全性方面,相比其他同類抗Aβ藥物,Lecanemab造成的腦水腫和腦出血的發(fā)生率相對較低,分別為12.6%和17.3%。該試驗也報告了總數(shù)不到1%的死亡病例,其中治療組有6例,安慰劑組有7例,研究者表示,沒有死亡病例與Lecanemab相關(guān)。(詳見澎湃科技報道:《阿爾茨海默病藥物L(fēng)eqembi有望獲美國FDA完全批準》)
FDA提到,Leqembi 最常見的副作用是頭痛、輸液相關(guān)反應(yīng)和淀粉樣蛋白相關(guān)成像異常 (ARIA)。這是一種已知針對淀粉樣蛋白的抗體類會發(fā)生的副作用。
“ARIA 最常表現(xiàn)為影像學(xué)研究中所見的大腦區(qū)域暫時性腫脹,通常會隨著時間的推移而消退,并可能伴有大腦內(nèi)部或表面的小出血點。 盡管 ARIA 通常不伴有任何癥狀,但可能會出現(xiàn)癥狀,包括頭痛、意識模糊、頭暈、視力改變和惡心。 ARIA 也很少會出現(xiàn)嚴重且危及生命的腦水腫,可能與癲癇和其他嚴重的神經(jīng)系統(tǒng)癥狀有關(guān)。 使用此類藥物治療的患者可能會發(fā)生腦出血,并且可能致命。 ”FDA稱,處方信息中包含黑框警告,提醒患者和護理人員與 ARIA 相關(guān)的潛在風(fēng)險。
此外,接受 Leqembi 治療的 ApoE ε4 等位基因純合子患者的 ARIA 發(fā)生率,高于該基因雜合子和未攜帶該基因的患者,包括有癥狀、嚴重和重度 ARIA。 處方信息指出,在開始 Leqembi 治療之前應(yīng)進行 ApoE ε4 基因檢測,以了解發(fā)生 ARIA 的風(fēng)險。(在APOE的3個等位基因中,APOEε4被公認為阿爾茨海默病的最強風(fēng)險基因。)
與安慰劑相比,服用 Leqembi 的患者使用抗凝藥物與腦出血數(shù)量增加相關(guān)。 處方信息建議,在服用抗凝劑或存在其他腦出血危險因素的患者中考慮使用 Leqembi 時應(yīng)謹慎。
對 Lecanemab-irmb 或其任何非活性成分嚴重過敏的患者禁用 Leqembi。 不良反應(yīng)可能包括血管性水腫(腫脹)和過敏反應(yīng)。
FDA強調(diào),Leqembi 用于阿爾茨海默病的治療,應(yīng)從患有輕度認知障礙或阿爾茨海默病輕度癡呆階段的患者中開始,這些患者是臨床試驗中研究治療的人群。 該藥說明書指出,沒有關(guān)于在疾病早期或晚期開始治療的安全性或有效性數(shù)據(jù)。
隨著中國日漸成為國際新藥研發(fā)的重要組成部分,為了補充中國人群數(shù)據(jù),由首都醫(yī)科大學(xué)宣武醫(yī)院牽頭,Lecanemab的3期研究也在我國的21家醫(yī)院開展,第一例受試者于2020年11月10日入組,受試者總數(shù)為111人。
澎湃科技記者從衛(wèi)材公司獲悉,這項臨床研究已于今年6月6日完成,預(yù)計在今年10月初公布結(jié)果。2022年12月,Lecanemab已在中國申報上市,最快預(yù)計在2024年上半年獲批。
近日,澎湃科技記者專訪了參與這項研究的首都醫(yī)科大學(xué)宣武醫(yī)院神經(jīng)內(nèi)科主任醫(yī)師魏翠柏教授,請其解讀Lecanemab在臨床試驗中顯示的療效以及上市的意義。
【對話】
澎湃科技:CLARITY AD中國臨床研究進展如何,有沒有初步的觀察結(jié)果?
魏翠柏(首都醫(yī)科大學(xué)宣武醫(yī)院神經(jīng)內(nèi)科主任醫(yī)師):目前這項研究已經(jīng)基本“關(guān)窗”,今年10月研究報告就會出來。從臨床初步的一些觀察來看,受試者的反應(yīng)和癥狀的改善,包括一些不良事件,應(yīng)該都跟國外已經(jīng)公布的數(shù)據(jù)差不多,中國人群和外國人群的研究結(jié)果應(yīng)該是比較一致的。
澎湃科技:患者招募的過程順利嗎?就你的接觸了解,他們在入組前對Lecanemab有怎樣的期待?
魏翠柏:Lecanemab是一款對因治療的藥物,在中國的招募比較順利,比預(yù)計時間早了一個多月完成。有很多患者看到醫(yī)院公眾號的通知,就主動找過來想?yún)⒓舆@個研究項目。
每個研究中心(參與臨床試驗的醫(yī)院)的受試者在10例上下。臨床試驗方案本身允許患者之前用過一些治療AD的藥物,比如膽堿酯酶抑制劑,但我印象比較深的一個患者,他是首診,只用了Lecanemab一個藥物,在4個多月左右時,我問他感覺怎么樣,他說還挺好的,患者自己感覺頭腦清醒一些了。
至少這4個月期間患者自覺沒有進展,我現(xiàn)在還沒有看到患者最后的臨床評估結(jié)果。這只是個案,不能代表整個群體患者的情況,具體還要等到研究報告出來后,用數(shù)據(jù)來體現(xiàn)。
澎湃科技:Lecanemab針對的人群是早期患者,他們在入組時的癥狀如何?
魏翠柏:早期治療、早期干預(yù)符合我們現(xiàn)在對于AD管理的理念。在AD人群中,這些患者屬于輕度認知障礙(MCI)或輕度癡呆階段,癥狀是偏輕的,典型癥狀就是記憶力下降,可能伴有一點言語障礙、找詞或命名困難等,僅在復(fù)雜的日常生活中稍微受到影響,但可以通過提示或他人輕微輔助來完成。
我們現(xiàn)在認為,Aβ是AD的一個致病蛋白,當它累積到一定程度,會出現(xiàn)很多病理性的損害,因此清除Aβ可以一定程度上阻斷或逆轉(zhuǎn)疾病的進程。在疾病的早期,有很長的時間窗口可以干預(yù),Lecanemab的研發(fā)就是針對這個傾向,越早清除Aβ,后期治療效果可能更好。就Lecanemab的作用來說,它對于清除毒性更強的Aβ寡聚體和原纖維,都有一定效果。
澎湃科技:過去靶向Aβ的藥物臨床試驗失敗,是否就和患者大腦中已經(jīng)沉積過多的Aβ有關(guān)?
魏翠柏:這是一個很復(fù)雜的問題,藥品研發(fā)失敗不一定取決于患者疾病進程較晚。我們目前一線用的藥物膽堿酯酶抑制劑、美金剛用于治療輕度、中度、重度患者一樣有效,但它不是針對疾病病因本身的,而只是改善癥狀。所以一個藥品研發(fā)是否成功,主要看它的適應(yīng)癥人群和作用機制,對因治療和對癥治療的目的和期待是不同的。針對不同藥物的特點,可以選擇不同人群,用不同觀察指標去評價。
澎湃科技:Lecanemab在中國患者中使用的安全性怎么樣?
魏翠柏:從不良反應(yīng)事件的發(fā)生率看,中國和國際已公布的試驗數(shù)據(jù)差不多。大家最關(guān)心的淀粉樣相關(guān)影像學(xué)異常,包括腦水腫和腦出血,在我們醫(yī)院的11名受試者里,我個人感覺發(fā)生率并不高,暫時不知道全國整體數(shù)據(jù)。臨床試驗中對不良反應(yīng)事件的處理,有一套標準化模式,是國際通用的。
澎湃科技:中國研究中心對CLARITY AD研究的意義是什么?
魏翠柏:全球多中心臨床試驗采用統(tǒng)一的臨床方案,目的就是看這種藥物對于不同種族、地域的人群,是否具有相同的效果。我們的研究就貢獻了中國地區(qū)數(shù)據(jù),觀察了在中國人群特定遺傳基因背景和生活模式下,藥物的效果和安全性,對藥物在全球的效果做了補充和驗證。有了中國患者的數(shù)據(jù),也會更好地支持這個藥在中國的上市。
澎湃科技:你怎么看Lecanemab上市對患者的意義?
魏翠柏:Lecanemab對全世界AD患者的意義都很大,因為它真正實現(xiàn)了我們一直關(guān)心的從疾病病理機制上根本性的干預(yù)。1998年后,第二代膽堿酯酶抑制劑安理申上市以來,還沒有特別突破的藥物,我覺得像Aducanumab和Lecanemab從一定意義上來講打破了這種僵局,真正從病因的機制本身去開發(fā)了藥品,抑制這種疾病的根本性致病作用的一些關(guān)鍵的靶點,來做干預(yù)。所以,Lecanemab上市是阿爾茨海默病治療中一個里程碑性的突破,當然我們期望它更有效、更安全。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯(lián)網(wǎng)新聞信息服務(wù)許可證:31120170006
增值電信業(yè)務(wù)經(jīng)營許可證:滬B2-2017116
? 2014-2025 上海東方報業(yè)有限公司




