- +1
追問|張鋒團(tuán)隊首次在真核生物中發(fā)現(xiàn)新型“基因魔剪”,新時代開啟?
· 通過研究進(jìn)化起源,科學(xué)家在真核生物中發(fā)現(xiàn)了“基因魔剪”CRISPR系統(tǒng)的“遠(yuǎn)房表親”,有望實現(xiàn)更有效、精準(zhǔn)的基因編輯。
·源于細(xì)菌的初代基因編輯療法,對人體具有自身免疫不良反應(yīng)的潛在風(fēng)險。而源于真核生物的新型基因編輯工具,理論上更加安全,未來或可成為CRISPR系統(tǒng)有力的替代性選擇。
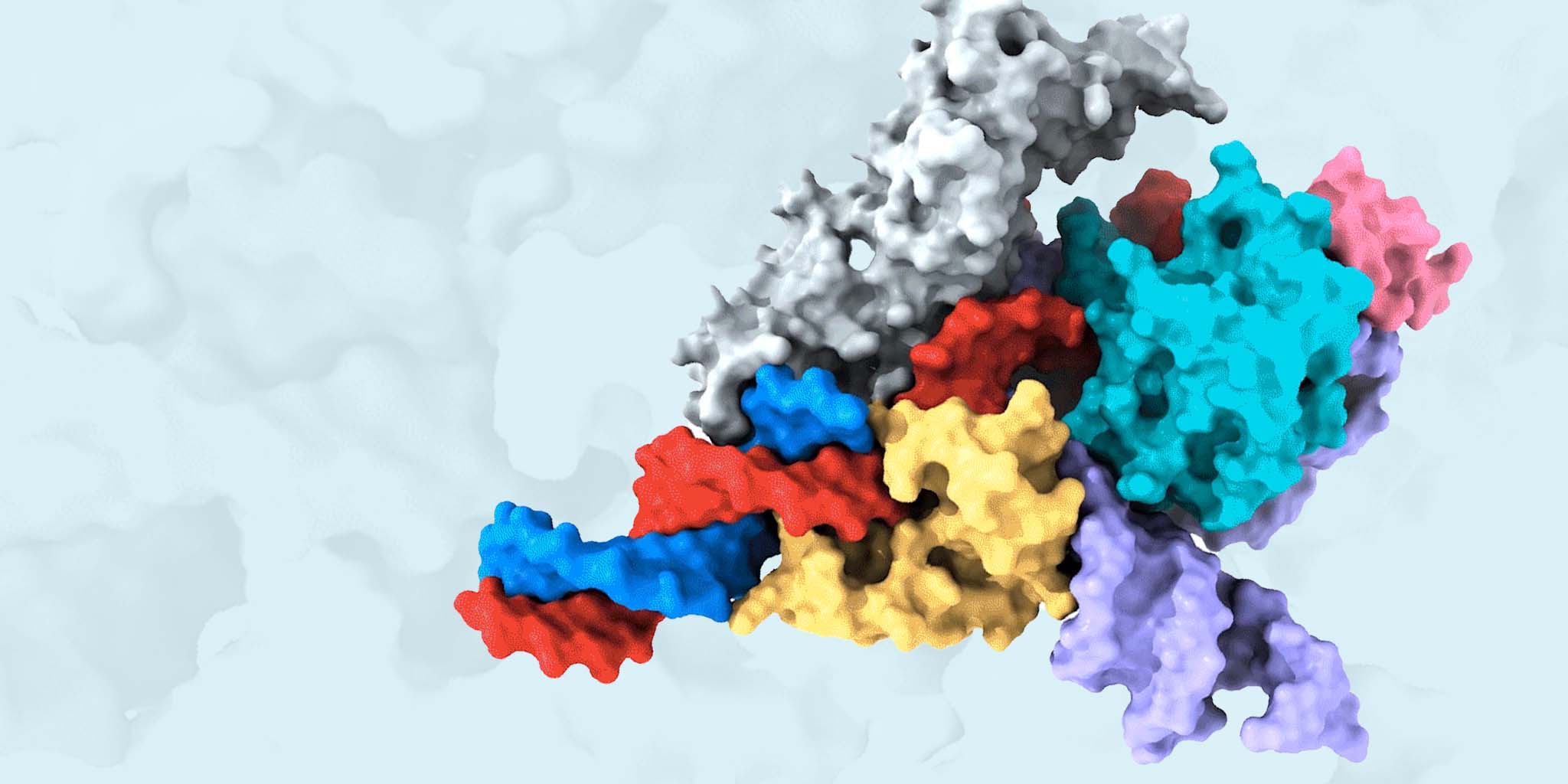
Fanzor 蛋白(灰色、黃色、淺藍(lán)色和粉色)與引導(dǎo)RNA(紫色)復(fù)合物及其靶標(biāo)DNA(紅色和藍(lán)色)的冷凍電鏡結(jié)構(gòu)圖。引導(dǎo)RNA用于指導(dǎo)Fanzor 蛋白對靶標(biāo)DNA的基因編輯,其中紅色為DNA雙鏈中的目標(biāo)鏈,藍(lán)色為非目標(biāo)鏈。圖片來源:張鋒實驗室
在細(xì)菌免疫系統(tǒng)中發(fā)現(xiàn)的“基因魔剪”CRISPR-Cas9,成就了兩位女性諾貝爾獎得主,由此開發(fā)的首個基因編輯療法有望在今年獲批上市。多年來,科學(xué)界涌現(xiàn)了一股在大自然中尋找類似Cas9的核酸酶的“淘金熱”,希望打造出更為銳利和精準(zhǔn)的基因編輯器,治療各種基因病。
如今,華裔基因編輯技術(shù)先驅(qū)張鋒朝這個目標(biāo)又跨出了重要一步。來自美國麻省理工-哈佛博德研究所及麻省理工學(xué)院麥戈文腦研究所的張鋒團(tuán)隊,首次在真核生物(藻類、真菌、植物和某些軟體動物)中發(fā)現(xiàn)了一種名為Fanzor的蛋白質(zhì),它和同屬CRISPR系統(tǒng)的Cas12酶擁有共同進(jìn)化起源。經(jīng)過系統(tǒng)工程改造優(yōu)化后,未來Fanzor有望應(yīng)用于新一代基因編輯器中。
相關(guān)論文于當(dāng)?shù)貢r間6月28日發(fā)表于頂級科學(xué)期刊《自然》(Nature)雜志。“這是研究生物多樣性力量的又一個例子,可能還有更多有趣和潛在有用的(基因編輯)系統(tǒng)等待被發(fā)現(xiàn)和利用。”張鋒對行業(yè)媒體Endpoints表示。
“這項研究最大的亮點是在真核生物中發(fā)現(xiàn)了RNA引導(dǎo)的基因編輯系統(tǒng),因為和細(xì)菌等原核生物相比,在物種進(jìn)化上真核生物離人類更近。”上海科技大學(xué)生命科學(xué)與技術(shù)學(xué)院教授、基因編輯中心主任陳佳告訴澎湃科技記者,由于之前發(fā)現(xiàn)的CRISPR系統(tǒng)主要來源于細(xì)菌并且往往是病菌,因此人體內(nèi)可能已經(jīng)存在Cas9蛋白的抗體,利用CRISPR-Cas9進(jìn)行基因治療時,或許會引起一些不必要的免疫反應(yīng),造成不良的治療后果。
“基于Fanzor開發(fā)的新型基因編輯工具,將會為這類患者提供新的選擇,減少基因治療過程中的潛在風(fēng)險。”陳佳補(bǔ)充道,目前基因編輯療法的臨床應(yīng)用剛剛起步,主要針對嚴(yán)重威脅生命健康的單基因遺傳病等展開,臨床試驗招募的患者人數(shù)并不多,因此自身免疫不良反應(yīng)方面的隱患可能尚未展現(xiàn)。
仍需優(yōu)化,提高基因編輯有效性和安全性
CRISPR是最早在大腸桿菌的基因體中發(fā)現(xiàn)的一段規(guī)律性序列,后來被證明是細(xì)菌免疫系統(tǒng)機(jī)制。細(xì)菌遭到病毒攻擊后,會挑選病毒的一段DNA碎片插入自己的CRISPR序列,并生成互補(bǔ)的引導(dǎo)RNA。在病毒下次入侵時,細(xì)菌體內(nèi)的Cas9活性酶就可以快速識別病毒DNA并將其切割摧毀。
基于這一原理,改造后的CRISPR-Cas9系統(tǒng)可以識別和切割與引導(dǎo)RNA互補(bǔ)的DNA序列,通過DNA修復(fù)機(jī)制進(jìn)行基因編輯、插入或敲除。
2021年,通過重建CRISPR-Cas9系統(tǒng)的進(jìn)化起源,張峰團(tuán)隊發(fā)現(xiàn)了三種可編程RNA引導(dǎo)的核酸酶,其中TnpB可能是CRISPR-Cas12的祖先,推測TnpB也具備RNA引導(dǎo)的核酸酶活性。
張鋒團(tuán)隊的最新研究表明,TnpB也可能是Fanzor蛋白的祖先。研究者測試了四種Fanzor酶與引導(dǎo)RNA配對的復(fù)合物,其中三種可以實現(xiàn)對目標(biāo)DNA序列的編輯,編輯效率最高達(dá)到11.8%,與早期版本的CRISPR基因編輯系統(tǒng)相當(dāng)。
研究者選擇了土壤里的真菌Spizellomyces punctatus中的Fanzor酶(SpuFz)作進(jìn)一步優(yōu)化,確定了三個可以改進(jìn)其基因編輯效率的突變,使其對一種目標(biāo)DNA序列實現(xiàn)了18.4%的編輯效率(大多數(shù)測試的靶標(biāo)編輯效率約為10%~15%)。在引入這一系列突變后,F(xiàn)anzor酶活性提高了10倍。
“我們?nèi)匀恍枰M(jìn)一步設(shè)計這種酶,讓它比得上Cas9酶基因編輯效率的金標(biāo)準(zhǔn)。”張鋒談道,SpuFz的其中一個獨(dú)特優(yōu)勢在于,它不像Cas12蛋白具有旁切活性(collateral activity),因此可以實現(xiàn)更有針對性的基因編輯。
旁切活性是基因編輯常被詬病的“脫靶效應(yīng)”的可能機(jī)制之一。即核酸酶在RNA引導(dǎo)下切割DNA的同時,還會降解目標(biāo)位點附近的DNA,可能導(dǎo)致非預(yù)期的DNA雙鏈斷裂,乃至引發(fā)細(xì)胞凋亡或癌變。
“這篇文章并沒有直接檢測Fanzor系統(tǒng)基因編輯的脫靶情況,我認(rèn)為這種可能性仍然存在。”陳佳向澎湃科技記者介紹,目前針對Cas酶的大量優(yōu)化工作,已經(jīng)可以很好地降低其在脫靶位點的編輯效率,相信同樣的策略也可以應(yīng)用在Fanzor系統(tǒng)開發(fā)上。

張鋒首次將CRISPR-Cas9應(yīng)用于哺乳動物基因組編輯,獲得了關(guān)鍵專利,但與諾貝爾獎失之交臂。2020年,諾貝爾化學(xué)獎授予另兩位基因編輯研究先驅(qū)詹妮弗·杜德納(Jennifer Doudna,圖右)與埃馬紐埃爾·卡彭蒂耶(Emmanuelle Charpentier)。圖片來源:Bloomberg
新型“迷你”基因編輯器,更易遞送入人體
在2021年的研究中,除了TnpB,張鋒團(tuán)隊發(fā)現(xiàn)的可編程RNA引導(dǎo)的核酸酶還有IscB和IsrB。其隨后的研究表明,尺寸更小的IsrB很可能是IscB的前身,而IscB正是Cas9的祖先。
在IscB發(fā)現(xiàn)后不到兩年時間,經(jīng)過對其大量優(yōu)化和改造,中科院神經(jīng)所研究員楊輝團(tuán)隊開發(fā)出了兩個“迷你型”堿基編輯器,在真核細(xì)胞中的單堿基編輯效率最高可達(dá)92%。文章于今年5月25日發(fā)表于科學(xué)期刊《自然-方法》(Nature Methods)。
堿基編輯器是新一代基因編輯工具,又被稱作“基因鉛筆”,可以在不產(chǎn)生DNA雙鏈斷裂的情況下,定向“擦除”和“重寫”基因組的單個堿基,因此也被認(rèn)為有更好的安全性。
“新的此類核酸酶的挖掘,可以進(jìn)一步擴(kuò)展底層平臺性技術(shù),構(gòu)建新型堿基編輯器、先導(dǎo)編輯器等。”陳佳指出,F(xiàn)anzor同樣也可用于新型基因編輯器開發(fā),預(yù)期可能在近年內(nèi)實現(xiàn)。
和IscB一樣,尺寸較小也是Fanzor的另一優(yōu)勢。這類酶約含400~700個氨基酸,平均算來僅有常用Cas9酶的四成大小。目前常用的腺病毒載體有容量限制,越小的基因編輯器,越容易被遞送到人體內(nèi)。
不過,在最近接受Endpoints的采訪中,張鋒表示,圍繞各類Fanzor蛋白組建新公司“還為時過早”。
公開資料顯示,張鋒至少已經(jīng)成立了8家生物技術(shù)公司,涵蓋傳統(tǒng)CRISPR基因編輯、堿基編輯療法開發(fā)、基于CRISPR的分子診斷、新型基因工具開發(fā)等多個方向。首家成立的公司Editas Medicine持有CRISPR關(guān)鍵專利,但基因編輯相關(guān)項目的臨床試驗結(jié)果和開發(fā)進(jìn)度落后于兩位諾獎得主創(chuàng)辦的公司。(詳見澎湃科技報道:《基因編輯明星公司首個臨床試驗折戟,初代“基因魔剪”不被看好》)
“和其他新發(fā)現(xiàn)的核酸酶一樣,F(xiàn)anzor距離臨床治療還有一段距離,需要提高編輯效率和系統(tǒng)穩(wěn)定性、解決遞送問題等。”陳佳介紹,目前進(jìn)入臨床的仍然只有基于CRISPR-Cas9系統(tǒng)的基因編輯療法,因為它發(fā)現(xiàn)得最早,全球諸多科學(xué)家集中大量精力和資源對其進(jìn)行研究和改造,相對最為成熟。
打開基因編輯工具的天然“寶庫”
此外,陳佳還指出,在技術(shù)開發(fā)的角度外,張鋒團(tuán)隊的這篇論文發(fā)現(xiàn)的這類新現(xiàn)象,提出了一個有意思的科學(xué)問題,值得科學(xué)界深入探索,“CRISPR系統(tǒng)在細(xì)菌體內(nèi)發(fā)揮免疫功能,而真核生物有另外的防御系統(tǒng),那么Fanzor蛋白在真核生物中天然的生理功能是什么?這篇文章沒有完全揭示,而是在‘討論’部分說有待研究。” 在他看來,F(xiàn)anzor蛋白未知的生理功能對人體有危害的概率不大。
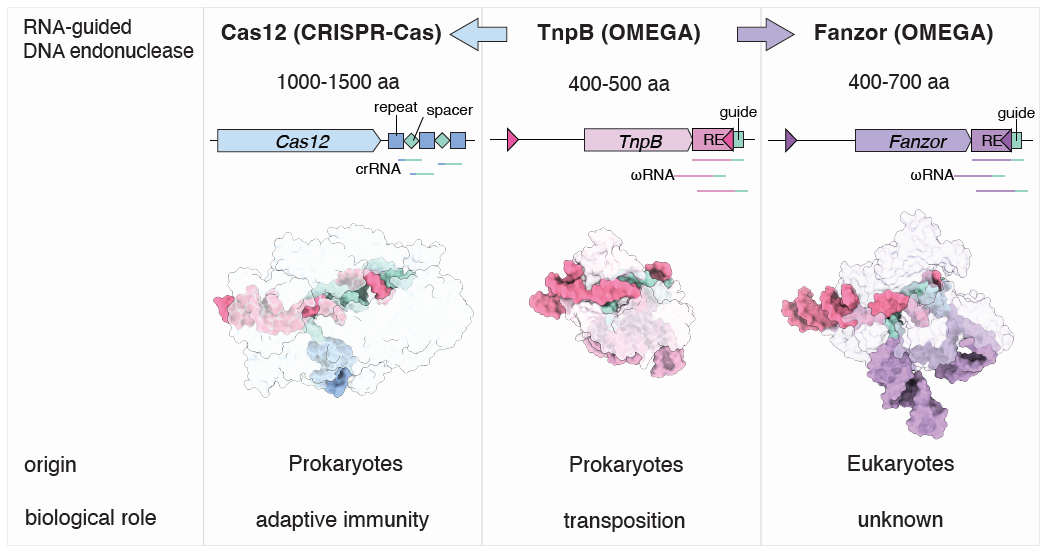
Fanzor 、CRISPR系統(tǒng)中的Cas12與兩者的共同祖先TnpB的結(jié)構(gòu)對比。張鋒團(tuán)隊論文指出,F(xiàn)anzor的生理作用仍然未知,有待研究。圖片來源:論文截圖
此前,張鋒團(tuán)隊將IscB、IsrB、TnpB命名為OMEGA家族,它們都由微生物基因組中的轉(zhuǎn)座子編碼。轉(zhuǎn)座子是一種遺傳元素,又被稱為“跳躍基因”,可以跨物種轉(zhuǎn)移,在基因組內(nèi)移動并自行復(fù)制粘貼,對于促進(jìn)生物多樣性和適應(yīng)性發(fā)揮著重要作用。系統(tǒng)發(fā)育分析表明,F(xiàn)anzor基因的直系祖先正是通過這種水平基因轉(zhuǎn)移機(jī)制(有別于親子代間的垂直遺傳),從細(xì)菌“跳躍”到了真核生物中。
張鋒過去的學(xué)生奧馬爾·阿布達(dá)耶(Omar Abudayyeh)和喬納森·古騰伯格 (Jonathan Gootenberg)目前和張鋒在麥戈文腦研究所共用一個實驗室。兩周前,他們在預(yù)印本網(wǎng)站bioRxiv上發(fā)布了他們關(guān)于Fanzor類蛋白基因編輯能力的研究,該論文正在科學(xué)期刊審稿過程中等候發(fā)表。
他們的工作主要集中于在真核生物中尋找不同的 Fanzor 蛋白并分類。他們將這些蛋白共同命名為 HERMES家族。目前看來,它們顯示出的基因編輯效率還低于張鋒發(fā)表的研究。阿布達(dá)耶在個人推特主頁上介紹,研究繪制了從TnpB到HERMES的進(jìn)化路徑,發(fā)現(xiàn)HERMES已經(jīng)進(jìn)化出高密度的內(nèi)含子和核入侵信號(NLS)序列,表明它在真核生物中經(jīng)歷了廣泛和長期的適應(yīng)性進(jìn)化,可能獲得了新的功能。
“雖然HERMES可能在指導(dǎo)真核生物轉(zhuǎn)座子在基因組中的位移方面發(fā)揮作用,類似于TnpB蛋白,但這種作用的確切性質(zhì)仍然未知。我們對研究HERMES在真核生物中功能的許多新方向感到興奮,并將其作為潛在(基因編輯)工具進(jìn)行工程設(shè)計。”阿布達(dá)耶表示。
康奈爾大學(xué)華裔研究員柯愛龍(Ailong Ke)在接受Endpoints采訪時亦表示,張鋒團(tuán)隊的最新研究“令人興奮”且“異常優(yōu)雅”。他認(rèn)為,源自真核生物的基因編輯系統(tǒng)可能已經(jīng)進(jìn)化到在大型和復(fù)雜的基因組中工作良好,理論上說,“對于真核基因編輯,它們可能更有效甚至更精確。”
“HERMES核酸酶在不同真核生物譜系及其相關(guān)病毒中的廣泛分布表明,真核生物中可能存在更多未知的RNA引導(dǎo)系統(tǒng),為未來表征和開發(fā)新生物技術(shù)提供了豐富的資源。”阿布達(dá)耶還寫道。
參考文獻(xiàn):
1. https://www.nature.com/articles/s41586-023-06356-2
2. https://www.science.org/doi/10.1126/science.abj6856
3. https://www.nature.com/articles/s41592-023-01898-9
4. https://endpts.com/feng-zhangs-lab-unveils-new-fanzor-gene-editing-tool-made-from-eukaryotic-proteins/





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯(lián)網(wǎng)新聞信息服務(wù)許可證:31120170006
增值電信業(yè)務(wù)經(jīng)營許可證:滬B2-2017116
? 2014-2025 上海東方報業(yè)有限公司




