- +1
盤點(diǎn)國內(nèi)在研新冠小分子藥管線,藥物研發(fā)如何才能跑贏病毒?
·“目前在研的這些藥物,多數(shù)最大的問題就是沒有具體的數(shù)據(jù),而很多已經(jīng)發(fā)布的數(shù)據(jù)是單一的,沒有可比性,所以很難對它們做出很科學(xué)客觀的評價。”
·短期內(nèi),我們對新冠藥物的需求是:同等有效但更安全,減少藥物間的相互作用,若能實(shí)現(xiàn)更高的有效性當(dāng)然更好。長期而言,前瞻地、預(yù)見性地開發(fā)廣譜抗病毒藥物,做好藥物研發(fā)儲備,才能在未來更好更快地應(yīng)對全球公共衛(wèi)生事件。
美國輝瑞公司的Paxlovid在中國國家醫(yī)保談判中的折戟,令人們將期待轉(zhuǎn)到國內(nèi)多款在研的新冠抗病毒藥物。
根據(jù)不同的靶點(diǎn)和作用機(jī)制,澎湃科技梳理了國內(nèi)在研的幾款新冠抗病毒藥物管線,希望觀其進(jìn)展,窺見國產(chǎn)在研新冠抗病毒藥物的“版圖”。為此,1月5日,澎湃科技專訪了清華大學(xué)藥學(xué)院原院長、全球健康藥物研發(fā)中心(GHDDI)主任丁勝教授。
丁勝教授告訴澎湃科技,目前國內(nèi)在研新冠抗病毒藥物最大的問題是沒有具體的數(shù)據(jù),因而很難對其做出科學(xué)客觀的評價,或具體的預(yù)測。他表示,在短期內(nèi),我們需要的是更加安全,具有更少相互作用的藥物,而從長期來看,需要前瞻地、預(yù)見性地開發(fā)一些廣譜的抗病毒藥物,以應(yīng)對未來可能出現(xiàn)的另一個對人類社會產(chǎn)生重大影響的新病毒。
兩種研發(fā)思路
2022年12月29日,清華大學(xué)醫(yī)院管理研究院發(fā)布的《新冠小分子口服藥研究進(jìn)展》報告顯示,從藥物結(jié)構(gòu)特性看,新冠病毒感染的治療主要可分為小分子化學(xué)藥物和大分子生物藥物兩大類。
丁勝介紹,針對新冠病毒的大分子藥物和小分子藥物從目標(biāo)上來講是一致的,都是為了阻止病毒進(jìn)一步復(fù)制,但二者的形式和作用機(jī)制不一樣。大分子藥物包括但不限于抗體藥物,從2020年秋季開始,已有多款針對新冠病毒的抗體藥物進(jìn)入臨床,獲批上市,但隨著新冠病毒不斷變異,上市的抗體藥物幾乎對現(xiàn)在主要流行株奧密克戎及其在不同地區(qū)衍生的突變株都已經(jīng)無效了,僅剩一兩個仍有效的,但效力也有所降低。
這是因?yàn)椋贵w藥物的作用原理是通過特異性結(jié)合新冠病毒S蛋白(刺突蛋白),阻斷病毒與人體細(xì)胞受體ACE2蛋白結(jié)合,從而抑制病毒侵染正常細(xì)胞。但新冠病毒表面的S蛋白上經(jīng)常發(fā)生突變,產(chǎn)生變異株逃逸,從而導(dǎo)致抗體藥物失效。“這就是目前已上市抗體藥物最待突破的瓶頸。”丁勝說,仍在研發(fā)中的抗體藥物,對于新的變異株還是可能有效的,但仍要看最后的結(jié)果,即使有效,也仍然逃不開其局限性,即,由于病毒的突變,可能未來又失效,“這樣的事情已經(jīng)反反復(fù)復(fù)地發(fā)生了”。與新冠口服小分子藥物相比,抗體藥物還有其他一系列局限性,比如,生產(chǎn)成本高,一般需要低溫冷藏,儲存和運(yùn)輸?shù)某杀据^高,大多數(shù)是靜脈注射(也有皮下注射),使用不便,可及性不高等。
廣東深圳某三甲醫(yī)院的一位醫(yī)生告訴澎湃科技,相比小分子抗病毒藥物,抗體藥物能直接快速起效,對肝腎功能要求低,作用時間更長,藥物之間相互作用也更少。而小分子抗病毒藥物的特點(diǎn)在于可以口服,對于一切重癥及免疫抑制患者,如胃腸能耐受,肝腎功能正常,必要時可以延長療程。
“小分子抗病毒藥物的好處是對不同的突變株有效,至少到目前為止,五六代下來都是有效的,但是未來也可能出現(xiàn)耐藥的突變株。此外,大部分小分子藥物的生產(chǎn)成本低,存儲運(yùn)輸方便。”丁勝說。
據(jù)清華大學(xué)醫(yī)院管理研究院《新冠小分子口服藥研究進(jìn)展》報告梳理,目前,治療新冠病毒感染小分子藥物的開發(fā)策略主要包括從頭藥物設(shè)計(jì)、“老藥新用”、藥物的虛擬篩選等3種策略。
從頭藥物設(shè)計(jì),一般是基于靶標(biāo)的結(jié)構(gòu)生物學(xué)為指導(dǎo),利用合理藥物設(shè)計(jì)等手段,設(shè)計(jì)特異性靶向某個蛋白的藥物開發(fā)方法。從頭藥物設(shè)計(jì)往往需要消耗大量的研發(fā)時間和研發(fā)費(fèi)用。但是,因?yàn)槠湓O(shè)計(jì)方法的合理性,其最終發(fā)現(xiàn)的藥物分子往往也具有較好的活性和成藥性。
“老藥新用”,是一種快速高效的藥物發(fā)現(xiàn)策略,這些潛在藥物分子具有已經(jīng)證實(shí)的藥代動力學(xué)性質(zhì)及安全性評價,因此可以避免藥物研發(fā)前期漫長而高昂的評價過程,從而降低研發(fā)成本,縮短研發(fā)時間。
藥物的虛擬篩選,即利用計(jì)算機(jī)建模或者分子動力學(xué)等方法,對化合物庫進(jìn)行虛擬篩選。一方面可以對大規(guī)模的化合物庫進(jìn)行篩選,有利于發(fā)現(xiàn)結(jié)構(gòu)新穎的藥物分子;另一方面,虛擬篩選可以節(jié)約大量的研發(fā)成本。但是,由于虛擬篩選的局限性,往往篩選所得的分子還需要進(jìn)一步的化學(xué)結(jié)構(gòu)改造與修飾。
丁勝教授在接受澎湃科技采訪時表示,“過去三年,用于治療新冠的老藥,無論在動物模型上,體內(nèi)或體外,有作用的其實(shí)非常多。其中有一部分在新冠患者中做了人體臨床試驗(yàn),研究人員嘗試了很多靶點(diǎn),但真正被驗(yàn)證有效的非常少,基本都失敗了。所以如果有人說,我發(fā)現(xiàn)了一個藥物,特別是老藥,對新冠病毒有效果,不奇怪,這種事情在過去的三年中發(fā)生過上百次。哪怕進(jìn)入了臨床試驗(yàn),它對新冠病毒的有效性需要等到最終的結(jié)果出來才可以判斷。”
兩個主要靶點(diǎn)
主蛋白酶(Mpro/3CLpro)和RNA聚合酶(RdRp)是目前新冠小分子藥物開發(fā)的兩個主要靶點(diǎn)。上述深圳某三甲醫(yī)院醫(yī)生向澎湃科技介紹,RdRp主要是核苷類似物,可抑制病毒RNA復(fù)制,3CL主蛋白酶抑制劑則是抑制各種病毒結(jié)構(gòu)蛋白質(zhì)的合成。“人類不是第一次面對冠狀病毒,科學(xué)家曾針對這兩類靶點(diǎn)開發(fā)過治療其他病毒的藥物,所以已經(jīng)有了相當(dāng)多的認(rèn)知和經(jīng)驗(yàn)。”丁勝說。
科學(xué)家已經(jīng)揭示了新冠病毒(SARS-COV-2)入侵宿主細(xì)胞的機(jī)制。據(jù)清華大學(xué)醫(yī)院管理研究院的報告,SARS-COV-2通過病毒刺突蛋白S1亞基受體結(jié)合域(RBD)與宿主細(xì)胞血管緊張素轉(zhuǎn)換酶(ACE2)結(jié)合,啟動感染過程。SARS-COV-2與宿主細(xì)胞發(fā)生膜融合后,病毒基因組被釋放到宿主細(xì)胞的細(xì)胞質(zhì)中。在 RNA依賴的RNA聚合酶(RdRp)催化下,SARS-COV-2病毒基因組開始復(fù)制;復(fù)制完成后,結(jié)構(gòu)蛋白N、S、E和M同時也被翻譯合成;翻譯合成后,病毒基因組與S、E和M蛋白在內(nèi)質(zhì)網(wǎng)-高爾基體中共同組裝成新的病毒顆粒;最后,病毒顆粒被運(yùn)送到細(xì)胞表面并通過胞吐作用釋放到細(xì)胞外,形成新的子代病毒,釋放到宿主體內(nèi)。
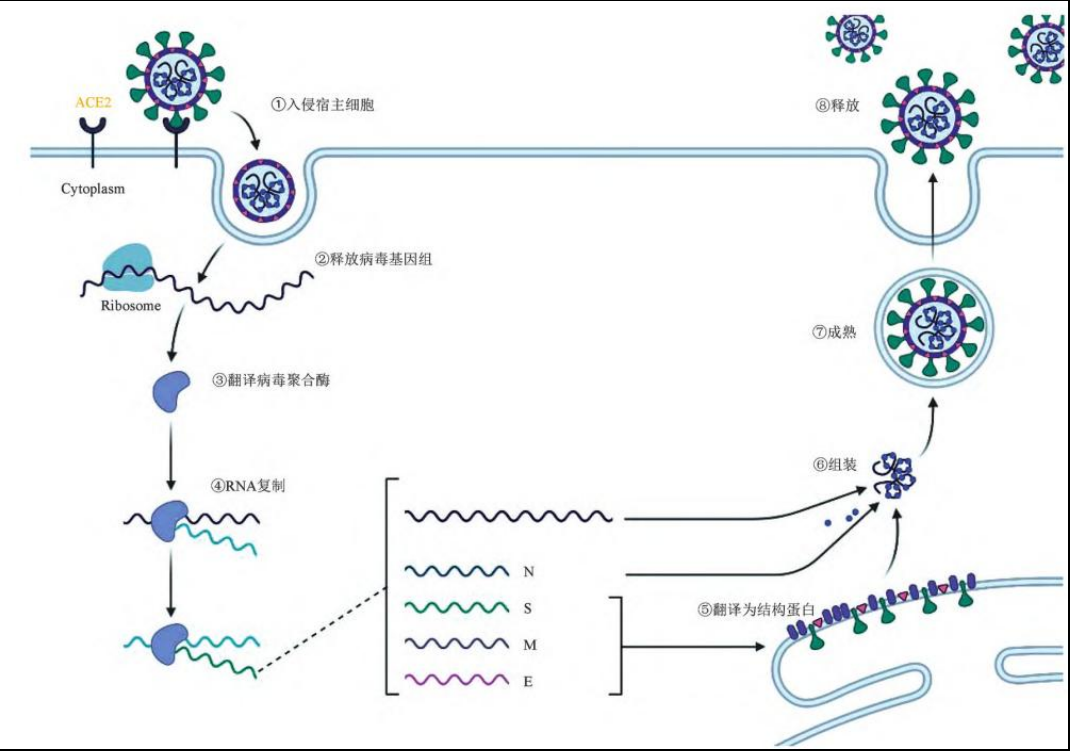
新冠病毒入侵宿主細(xì)胞過程。圖片來源:清華大學(xué)醫(yī)院管理研究院《新冠小分子口服藥研究進(jìn)展》報告
丁勝解釋,Mpro/3CLpro和RdRp這兩個靶點(diǎn)是整個病毒復(fù)制過程中兩個比較重要的“機(jī)器”,其中一部“機(jī)器”被關(guān)閉,病毒就不能進(jìn)一步復(fù)制。所以從人類的認(rèn)知、經(jīng)驗(yàn)和作用機(jī)制上來講,針對這兩個靶點(diǎn)進(jìn)行抗新冠病毒藥物研發(fā)都是很可行的。
“但開發(fā)這兩個靶點(diǎn)的難度是不一樣的。”丁勝說,RdRp靶點(diǎn)開發(fā)非常難,所以目前為止還沒有針對這個靶點(diǎn)開發(fā)出來的抗新冠病毒新藥,基本都是“老藥新用”。即,目前獲批和在研的針對RdRp靶點(diǎn)的藥物,基本都是先前針對別的病毒開發(fā)的藥物,被重新利用到新冠病毒的治療上。比如,美國吉利德科技公司的瑞德西韋(Remdesivir),最早是用于抗擊埃博拉病毒;2022年12月底在中國獲得緊急授權(quán)使用的默沙東公司的莫諾拉韋(Molnupiravir),最初是為治療流感病毒而設(shè)計(jì)的廣譜抗病毒藥物。
目前來看,大多數(shù)“老藥新用”的成功是非常有限的,所以很多研發(fā)機(jī)構(gòu)開始都針對新冠病毒本身的靶點(diǎn)和機(jī)制來開發(fā)藥物。
國內(nèi)在研的新冠抗病毒小分子藥物中,上海君實(shí)生物醫(yī)藥科技股份有限公司(君實(shí)生物,688180.SH)的VV116和科興制藥(688136.SH)旗下深圳科興藥業(yè)有限公司的SHEN26,都是根據(jù)瑞德西韋的分子改良而得,發(fā)揮藥效的代謝產(chǎn)物是一致的。它們是一個新的分子,但是從本質(zhì)上來講并不是一個全新的分子,因?yàn)橹蛔隽朔浅P〉母膭印1热?VV116的分子,(和瑞德西韋的原研藥廠吉利德的一款在研抗新冠藥物GS-5245相比),主要的改變是用重氫取代了原有的氫原子,分子量只差1。
針對Mpro/3CLpro主蛋白酶的藥物開發(fā)速度更快,所以就產(chǎn)生了輝瑞的Paxlovid。“但是它也有自己的挑戰(zhàn)。”丁勝指出,“輝瑞的Paxlovid,由奈瑪特韋片和利托納韋片兩個藥組成,奈瑪特韋很容易被人體肝臟中代謝酶清除,所以它在早期的暴露量不高,單獨(dú)使用這一個藥物,達(dá)不到有效抑制病毒的濃度,解決這個問題的辦法就是,用利托納韋來抑制肝臟中的代謝酶,來維持抗病毒藥物在體內(nèi)足夠的曝光。這個組合用藥的策略早在艾滋病、丙型肝炎藥物中就使用過,是一個標(biāo)準(zhǔn)的方法。”
然而,抑制肝臟代謝酶對于一些有基礎(chǔ)病,特別是心血管疾病的一些患者不友好。藥物的劑量和它的毒副作用相關(guān),例如,一個有高血壓的患者,需要吃一種降血壓的藥,如果這個降血壓藥也由肝臟中的這個代謝酶代謝,而新冠用藥抑制了肝臟中的這個代謝酶,那么降血壓藥的劑量也增加了,這就可能產(chǎn)生很大的毒副作用。
“現(xiàn)在有相當(dāng)多這樣(需要同時服用治療其他疾病藥物)的患者,特別是有基礎(chǔ)病的老年患者,他們其實(shí)才是新冠感染后的高危人群,也是真正有使用新冠抗病毒藥物需求的人。由于存在藥物沖突,目前的新冠抗病毒小分子藥物不能完全滿足他們的需求,因此,需要開發(fā)下一代的藥物。”丁勝說。
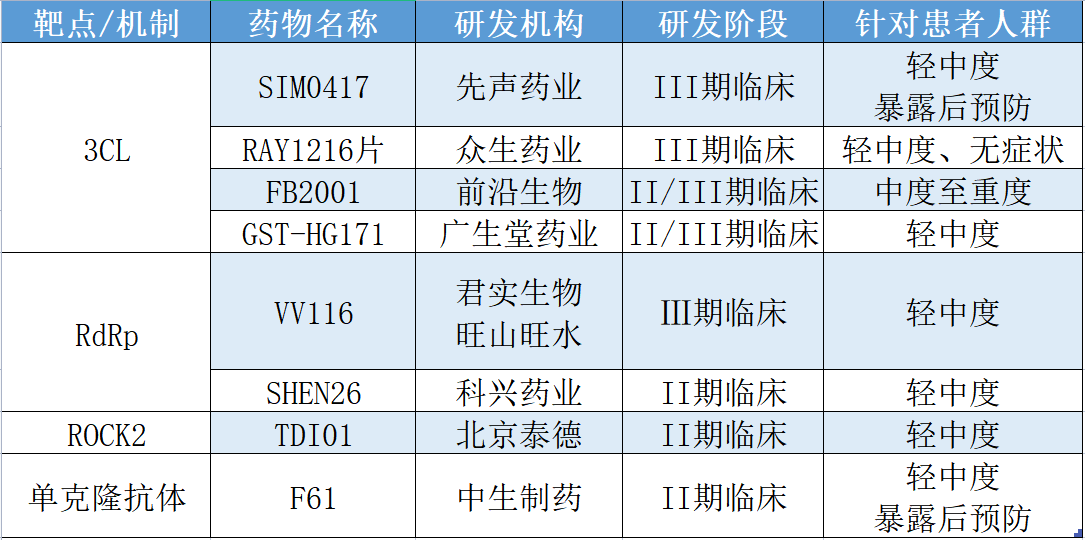
國產(chǎn)在研新冠抗病毒藥物進(jìn)展(不完全統(tǒng)計(jì))。 澎湃科技 制圖
競速3CL蛋白酶
全球已獲批上市的新冠抗病毒藥物中,美國輝瑞公司的奈瑪特韋/利托納韋(Paxlovid)、日本鹽野義制藥公司的Xocova片劑(Ensitrelvir)為3CL蛋白酶抑制劑。
國內(nèi)亦有多款3CL蛋白酶抑制劑在研,進(jìn)展較快的有先聲藥業(yè)(02096.HK)與中國科學(xué)院上海藥物研究所、中國科學(xué)院武漢病毒研究所合作開發(fā)的SIM0417,眾生藥業(yè)(002317.SZ)的RAY1216片,前沿生物(688221.SH)與中科院上海藥物研究所、中科院武漢病毒研究所共同開發(fā)的FB2001,以及廣生堂(300436.SZ)的GST-HG171等。
SIM0417:預(yù)計(jì)最快于2023年2月上市
SIM0417由先聲藥業(yè)(02096.HK)與中國科學(xué)院上海藥物研究所、中科院武漢病毒所合作開發(fā),是一種3CL蛋白酶抑制劑,為口服小分子藥物。2022年12月29日,江蘇省藥品監(jiān)督管理局發(fā)布公告稱,12月16日,先諾欣?(SIM0417)的Ⅲ期臨床研究已完成全部1208例患者入組,進(jìn)度處于國內(nèi)3CL靶點(diǎn)藥物第一位,預(yù)計(jì)最快于2023年2月上市。
2022年12月18日,先聲藥業(yè)發(fā)布公告稱,自2022年8月19日達(dá)成首例患者入組后,前述Ⅲ期臨床研究在4個月內(nèi)便完成了全部患者入組。該研究由中國工程院副院長、中國醫(yī)學(xué)科學(xué)院院長、北京協(xié)和醫(yī)學(xué)院校長王辰院士和中日友好醫(yī)院副院長曹彬教授牽頭,是迄今為止國內(nèi)外針對感染新冠奧密克戎毒株的中國患者人群,第一個進(jìn)入注冊性III期試驗(yàn)并完成全部計(jì)劃入組病例數(shù)的臨床研究。
該研究按照國際通行標(biāo)準(zhǔn)設(shè)計(jì)臨床終點(diǎn),在國內(nèi)20個省市自治區(qū)共設(shè)立43家臨床研究中心。臨床給藥方案為SIM0417對照安慰劑,連續(xù)口服5天,研究終點(diǎn)包括“至COVID-19癥狀恢復(fù)所需的時間”“病毒載量下降”等。
2022年10月,先聲藥業(yè)首席投資官周高波在接受媒體采訪時表示,SIM0417是中國國家藥品監(jiān)督管理局藥品審評中心(CDE)特別審批的第一個抗新冠口服小分子藥物,被列入國務(wù)院聯(lián)防聯(lián)控科研攻關(guān)重點(diǎn)目錄;也是國內(nèi)首個獲得臨床試驗(yàn)批件及目前唯一暴露后預(yù)防IND、國內(nèi)首個進(jìn)入II/III期臨床研究的3CL口服小分子藥物。
臨床試驗(yàn)登記網(wǎng)站ClinicalTrials顯示,2022年7月27日,江蘇先聲藥業(yè)有限公司注冊了SIM0417的I期臨床試驗(yàn)(NCT05475834),該試驗(yàn)是一項(xiàng)非隨機(jī)、開放標(biāo)簽、單劑量的研究,旨在評估單次口服SIM0417與利托那韋聯(lián)合給藥后,SIM0417在健康中國成年男性受試者中的質(zhì)量平衡和生物轉(zhuǎn)化、安全性和耐受性。該試驗(yàn)在山東第一醫(yī)科大學(xué)進(jìn)行,實(shí)際招募6名健康中國成年男性。2022年6月1日,山東第一醫(yī)科大學(xué)第一附屬醫(yī)院(山東省千佛山醫(yī)院)官網(wǎng)發(fā)布消息,項(xiàng)目主要研究者表示,SIM0417的I期研究提前完成末例患者給藥,藥物安全性良好,沒有出現(xiàn)與SIM0417相關(guān)聯(lián)的停藥事件。
RAY1216片:III期臨床研究已完成首例受試者入組
口服抗新冠病毒3CL蛋白酶抑制劑RAY1216片由廣東眾生藥業(yè)股份有限公司(眾生藥業(yè),002317.SZ)旗下子公司廣東眾生睿創(chuàng)生物科技有限公司研發(fā),現(xiàn)已進(jìn)展至III期臨床研究階段。
2022年11月14日,眾生藥業(yè)發(fā)布公告稱,RAY1216片的隨機(jī)、雙盲、安慰劑對照III期臨床研究已完成首例受試者入組。該研究在廣州醫(yī)科大學(xué)附屬第一醫(yī)院開展,擬入組1070例輕型和普通型新冠病毒感染患者,以安慰劑為對照,臨床給藥方案為單藥RAY1216片,連續(xù)口服5天,主要終點(diǎn)指標(biāo)為“至臨床癥狀持續(xù)恢復(fù)的時間”。
此前,眾生藥業(yè)已公開披露其I期臨床研究結(jié)果。2022年8月4日,眾生藥業(yè)發(fā)布公告稱,RAY1216片I期臨床研究共入組88例健康成人受試者,在吉林大學(xué)第一醫(yī)院和中山大學(xué)附屬孫逸仙醫(yī)院進(jìn)行。該I期臨床研究為隨機(jī)、雙盲、安慰劑對照、單次/多次給藥的劑量遞增研究,主要評估RAY1216片在健康受試者單次、多次給藥的安全性、耐受性、藥代動力學(xué)特征以及食物對藥代動力學(xué)的影響。
公告稱,試驗(yàn)結(jié)果初步表明,健康人單次口服不同劑量的RAY1216片具有良好的安全性和耐受性,血藥濃度和暴露量隨給藥劑量的增加而增加,相同給藥劑量下RAY1216的峰濃度或暴露量為文獻(xiàn)報道的同等劑量奈瑪特韋(PF-07321332)的2-3倍;連續(xù)5天給予3個不同劑量的RAY1216/利托那韋亦具有良好的安全性和耐受性,穩(wěn)態(tài)條件下RAY1216的峰濃度、谷濃度、平均濃度值、穩(wěn)態(tài)暴露量數(shù)值均高于文獻(xiàn)報道的同等劑量奈瑪特韋/利托那韋在日本人群的對應(yīng)數(shù)值。且整個試驗(yàn)過程中,無嚴(yán)重未預(yù)期的不良事件發(fā)生,所發(fā)生的不良事件均為輕度,且不需要醫(yī)療干預(yù)可自行恢復(fù)或好轉(zhuǎn)。
中國臨床試驗(yàn)注冊中心官網(wǎng)顯示,眾生藥業(yè)于2022年8月22日注冊了評價RAY1216片單藥及聯(lián)合利托那韋在SARS-CoV-2感染者中的有效性、安全性的IIT研究,該試驗(yàn)在海南省三亞中心醫(yī)院開展,擬招募研究對象100人,擬實(shí)施時間為2022年8月11日至2023年2月28日。2022年11月20日,眾生藥業(yè)又注冊了評價RAY1216片在SARS-CoV-2無癥狀感染者中的有效性、安全性的IIT研究,擬入組1000人,在廣州醫(yī)科大學(xué)附屬第一醫(yī)院開展試驗(yàn),擬實(shí)施時間為2022年11月13日至2023年1月23日,研究負(fù)責(zé)人為廣州醫(yī)科大學(xué)附屬第一醫(yī)院國家呼吸系統(tǒng)疾病臨床醫(yī)學(xué)研究中心主任、中國工程院院士鐘南山。該試驗(yàn)旨在評估評估RAY1216片抗SARS-CoV-2感染的有效性和安全性,以及對COVID-19臨床癥狀出現(xiàn)的預(yù)防作用。
FB2001:正推進(jìn)注射用和霧化吸入用的II/III期臨床試驗(yàn)
2023年1月3日,前沿生物藥業(yè)(南京)股份有限公司(前沿生物,688221.SH)最新公告披露,前沿生物與中科院上海藥物研究所、中科院武漢病毒研究所共同開發(fā)了抗新冠病毒3CL蛋白酶抑制劑FB2001(通用名:Bofutrelvir),目前,公司正在積極加速推進(jìn)注射用FB2001擬治療新冠病毒感染住院患者的II/III期臨床試驗(yàn)和霧化吸入用FB2001擬治療輕型、普通型新冠病毒感染患者的II/III期臨床試驗(yàn)。
公告稱,截至2022年12月31日,注射用FB2001的國際多中心、隨機(jī)、雙盲、安慰劑對照II/III期臨床試驗(yàn)已獲得中國、澳大利亞、菲律賓等多個國家的研究批準(zhǔn),受試者已入組并給藥。近期隨著各城市新冠病毒感染者的增加,公司將積極推進(jìn)臨床試驗(yàn)進(jìn)度、加快受試者入組工作。
據(jù)該公告介紹,F(xiàn)B2001具有以下技術(shù)特點(diǎn):
1、高效、廣譜的抗病毒活性。體外試驗(yàn)數(shù)據(jù)顯示,F(xiàn)B2001對主要流行的SARS-CoV-2變異病毒株Alpha、Beta、Delta、Omicron B.1.1.529及Omicron BA.2和Omicron BA.5均具有高效廣譜抑制活性。
2、安全性好、耐受性好。注射用FB2001在美國、中國的I期臨床試驗(yàn)已完成,具有良好的臨床安全性和耐受性,藥代動力學(xué)特征在美國和中國人群無人種差異;霧化吸入用FB2001在中國的I期臨床試驗(yàn)已完成,臨床試驗(yàn)數(shù)據(jù)顯示,霧化吸入用FB2001在呼吸道局部藥物濃度高,具有良好的臨床安全性和耐受性,無劑量限制性毒性。
臨床試驗(yàn)登記網(wǎng)站ClinicalTrials顯示,F(xiàn)B2001在美國的I / II期研究實(shí)際入組88名參與者,分為兩部分:第1部分評估FB2001在健康受試者中的最大耐受劑量,耐受性,安全性和藥代動力學(xué);第2部分評估FB2001在中度至重度COVID-19疾病患者中的安全性、藥代動力學(xué)和有效性。其在中國的橋接研究共入組40名參與者,是一項(xiàng)單劑量和多次給藥的隨機(jī)、雙盲、安慰劑對照研究,用以評估FB2001在中國健康人群中的安全性和PK。
3、 FB2001為單藥使用,無需聯(lián)合藥代動力學(xué)增強(qiáng)劑(利托納韋)。注射用FB2001、霧化吸入用FB2001均為單藥使用,臨床試驗(yàn)數(shù)據(jù)顯示,單藥給藥后在人體中的藥物濃度均已達(dá)到預(yù)測的有效劑量,可降低因使用藥代動力學(xué)增強(qiáng)劑(利托納韋)出現(xiàn)的潛在藥物相互作用風(fēng)險,預(yù)期適用的患者群體更為廣泛。
據(jù)稱,霧化吸入給藥方式,可直接將藥物遞送至上呼吸道和肺部,直接作用于靶器官,在局部實(shí)現(xiàn)高藥物濃度,預(yù)期可以加快癥狀的緩解和病毒的清除。同時,霧化吸入采用局部給藥方式,系統(tǒng)暴露量較小,預(yù)期藥物所致的全身毒副作用小,藥物相互作用更少,無需根據(jù)肝腎功能損害調(diào)整劑量。
此外,前述ClinicalTrials網(wǎng)站顯示,一項(xiàng)旨在評估FB2001在中度至重度COVID-19住院患者中的有效性和安全性的II/III期、雙盲、隨機(jī)、安慰劑對照、多中心研究顯示尚未招募,該研究計(jì)劃招募約1188名受試者,受試者將以1:1的比例隨機(jī)分配到FB2001組或安慰劑組,同時接受標(biāo)準(zhǔn)的護(hù)理治療。其主要的臨床終點(diǎn)為“從隨機(jī)分組到第 29 天的恢復(fù)時間”,次要終點(diǎn)包括“機(jī)械通氣或全因死亡的受試者比例”“每個目標(biāo)COVID-19體征/癥狀的嚴(yán)重程度,直到出院”等12項(xiàng)。該研究的首席研究員為張文宏,研究將在復(fù)旦大學(xué)附屬華山醫(yī)院、首都醫(yī)科大學(xué)附屬北京地壇醫(yī)院開展。
另有一項(xiàng)旨在評估FB2001氣溶膠吸入作為COVID-19患者密切接觸者暴露后預(yù)防的有效性、安全性和耐受性的研究也顯示尚未招募,該研究計(jì)劃招募20至60名年齡在18至65歲之間的COVID-19患者的密切接觸者,合作者和贊助者包括上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院、上海市疾病預(yù)防控制中心。
GST-HG171:II/III期臨床試驗(yàn)首例受試者已入組
2022年12月21日,福建廣生堂藥業(yè)股份有限公司(廣生堂,300436.SZ)公告稱,廣生堂創(chuàng)新藥控股子公司福建廣生中霖生物科技有限公司的口服小分子廣譜抗新冠病毒3CL蛋白酶抑制劑一類創(chuàng)新藥物GST-HG171片的II/III期無縫設(shè)計(jì)的關(guān)鍵性注冊臨床試驗(yàn)經(jīng)中國人類遺傳資源管理辦公室特殊審批批準(zhǔn),首例受試者已于2022年12月21日成功入組給藥。
據(jù)該公告介紹,GST-HG171片是具有全球自主知識產(chǎn)權(quán)的強(qiáng)效、廣譜、安全性優(yōu)異的抗新冠病毒3CL蛋白酶抑制劑,其II/III期關(guān)鍵性注冊臨床試驗(yàn)由廣州醫(yī)科大學(xué)附屬第一醫(yī)院和深圳市第三人民醫(yī)院擔(dān)任組長單位開展研究,旨在評估GST-HG171片聯(lián)合利托納韋片在輕型/普通型新型冠狀病毒肺炎(COVID-19)患者中的國際多中心、隨機(jī)、雙盲、安慰劑對照的有效性和安全性。項(xiàng)目委托杭州泰格醫(yī)藥科技股份有限公司作為主要臨床CRO公司(醫(yī)藥研發(fā)合同外包服務(wù)機(jī)構(gòu)),將快速在廣東、北京、上海、武漢、福建等超過20個主要醫(yī)療機(jī)構(gòu)開展相關(guān)注冊臨床研究。
中國臨床試驗(yàn)注冊中心官網(wǎng)顯示,2022年12月26日,廣生堂注冊了一項(xiàng)評估GST-HG171片聯(lián)合利托納韋片在輕型/普通型新型冠狀病毒肺炎患者中的國際多中心、隨機(jī)、雙盲、安慰劑對照的有效性、安全性的II/III期臨床研究(ChiCTR2200067088),研究顯示計(jì)劃招募1200名受試者,正在招募中,試驗(yàn)的主要臨床終點(diǎn)為“臨床癥狀持續(xù)恢復(fù)時間”,次要終點(diǎn)包括“第5天病毒載量較基線的變化”“發(fā)熱和呼吸道癥狀持續(xù)恢復(fù)時間”等5項(xiàng)。
次日,廣生堂補(bǔ)注冊了一項(xiàng)評估GST-HG171片聯(lián)合利托那韋在輕型/普通型COVID-19成人受試者中的有效性與安全性的隨機(jī)、對照的臨床研究(ChiCTR2200067137 ),設(shè)置實(shí)驗(yàn)組(使用GST-HG171片聯(lián)合利托那韋)、安慰劑組、陽性組(使用Paxlovid)各20人,試驗(yàn)的主要臨床終點(diǎn)為“核酸轉(zhuǎn)陰的時間”,次要終點(diǎn)包括“病毒載量相對于基線的變化”“核酸檢測陽性的受試者比例”等。
上述兩個研究負(fù)責(zé)人均為中國工程院院士鐘南山和深圳市第三人民醫(yī)院院長盧洪洲。
更難開發(fā)的RdRp抑制劑
在全球已上市新冠抗病毒藥物中,RdRp抑制劑主要有美國默沙東公司的莫諾拉韋(Molnupirvir)、美國吉利德科技公司研發(fā)的瑞德西韋(Remdesivir),以及河南真實(shí)生物科技有限公司的阿茲夫定(Azvudine)。
據(jù)清華大學(xué)醫(yī)院管理研究院《新冠小分子口服藥研究進(jìn)展》報告,針對RdRp靶點(diǎn)的藥物設(shè)計(jì)可分為2類,一類是插入終止,即藥物代謝產(chǎn)物模擬核苷類似物插入新生RNA,導(dǎo)致鏈延伸終止,如瑞德西韋、阿茲夫定;另一類是誘導(dǎo)突變,如莫諾拉韋。
針對這一靶點(diǎn),目前國內(nèi)在研的新冠抗病毒藥物主要有君實(shí)生物(688180.SH,01877.HK)和蘇州旺山旺水生物醫(yī)藥有限公司共同研發(fā)的VV116,以及科興制藥(688136.SH)的SHEN26等。
VV116:非劣效性Ⅲ期臨床試驗(yàn)已完成,更多Ⅲ期臨床試驗(yàn)進(jìn)行中
據(jù)君實(shí)生物微信公眾號發(fā)文介紹,VV116由中國科學(xué)院上海藥物研究所、中科院武漢病毒研究所、中科院新疆理化技術(shù)研究所、中科院中亞藥物研發(fā)中心/中烏醫(yī)藥科技城(科技部“一帶一路”聯(lián)合實(shí)驗(yàn)室)、蘇州旺山旺水生物醫(yī)藥有限公司和君實(shí)生物共同研發(fā)。
2021年12月31日,君實(shí)生物發(fā)布消息稱,烏茲別克斯坦衛(wèi)生部已批準(zhǔn)VV116的緊急使用授權(quán),用于治療COVID-19。
其最新的進(jìn)展為,北京時間2022年12月29日凌晨,國際頂級醫(yī)學(xué)期刊《新英格蘭醫(yī)學(xué)雜志》(The New England Journal of Medicine,NEJM,影響因子:176.079)在線發(fā)表了其非劣效性Ⅲ期隨機(jī)對照臨床試驗(yàn)(NCT05341609),結(jié)果表明,對于有高危因素的輕中度Covid-19成人患者,在至持續(xù)臨床康復(fù)時間方面,VV116非劣于奈瑪特韋片/利托那韋片組合藥物Paxlovid(4天 vs. 5天;風(fēng)險比,1.17;95%置信區(qū)間,1.02-1.36),且不良事件更少。
這項(xiàng)試驗(yàn)由上海交通大學(xué)醫(yī)學(xué)院附屬瑞金醫(yī)院趙任教授,上海交大醫(yī)學(xué)院附屬仁濟(jì)醫(yī)院皋源教授和中國工程院院士、上海瑞金醫(yī)院院長寧光牽頭,在7家上海醫(yī)院開展,這是奧密克戎(Omicron)變異株流行期間首個針對Covid-19患者開展的國產(chǎn)口服抗病毒藥物“頭對頭”Ⅲ期臨床試驗(yàn)。
然而,該項(xiàng)試驗(yàn)被質(zhì)疑未成功回答VV116是否有效。2022年12月30日,美國阿拉巴馬大學(xué)伯明翰分校遺傳學(xué)博士周葉斌指出,Paxlovd最顯著的療效是把高危人群住院死亡風(fēng)險降低了近90%,但是在VV116該項(xiàng)試驗(yàn)的受試者里,沒有需要住院的患者。在這一點(diǎn)上,不能證明其非劣性。此外,該項(xiàng)試驗(yàn)的終點(diǎn)——獲得癥狀持續(xù)緩解的時間,無安慰劑組對照,很難判斷其實(shí)際的有效性。
不過,VV116還有其他的III期臨床研究正在進(jìn)行中。臨床試驗(yàn)登記網(wǎng)站ClinicalTrials顯示,2022年10月17日,君實(shí)生物注冊了一項(xiàng)多中心、雙盲、隨機(jī)、安慰劑對照的III期臨床研究(NCT05582629),旨在評估JT001(VV116)在輕度至中度COVID-19 參與者中的療效和安全性,官網(wǎng)顯示正在招募中。該試驗(yàn)的首席研究員為中國工程院院士李蘭娟,試驗(yàn)將在上海、福建、廣東、內(nèi)蒙古等多地進(jìn)行。實(shí)驗(yàn)擬入組1200人,擬進(jìn)行時間為2022年10月21日至2023年5月30日。實(shí)驗(yàn)的主要臨床終點(diǎn)為“持續(xù)臨床癥狀消退的時間”,次要臨床終點(diǎn)包括“臨床緩解”“疾病進(jìn)展”“SARS-CoV-2核酸和病毒載量和安全”等。
此外,還有2項(xiàng)III期臨床研究顯示尚未招募,包括一項(xiàng)旨在評估VV116 在輕度至中度COVID-19參與者中早期治療COVID-19的有效性、安全性和藥代動力學(xué)的多中心、雙盲、隨機(jī)、安慰劑對照的II/III期研究(NCT05242042),以及一項(xiàng)旨在評估VV116與法匹拉韋在COVID-19參與者中的療效和安全性的多中心、雙盲、隨機(jī)、III期研究(NCT05279235),兩項(xiàng)研究均由國家傳染病醫(yī)學(xué)中心主任、復(fù)旦大學(xué)附屬華山醫(yī)院感染科主任張文宏、上海市公共衛(wèi)生臨床中心沈銀忠教授擔(dān)任首席研究員。
SHEN26:II期臨床研究全部受試者入組
2023年1月3日,科興制藥(688136.SH)公告稱,近日,科興生物制藥股份有限公司全資子公司深圳科興藥業(yè)有限公司的新冠小分子口服藥SHEN26膠囊II期臨床研究成功完成全部受試者入組。
據(jù)科興制藥2022年11月24日發(fā)布的公告,SHEN26膠囊II期臨床研究方案獲得組長單位深圳市第三人民醫(yī)院醫(yī)學(xué)倫理委員會臨床試驗(yàn)審查批件。該研究為治療輕型和普通型新型冠狀病毒肺炎感染患者的隨機(jī)、雙盲、安慰劑對照II期臨床研究,主要終點(diǎn)指標(biāo)為SARS-CoV-2病毒RNA水平(RT-PCR檢測)相對于基線的變化值,計(jì)劃在全國多家臨床研究中心開展。此外,基于已有的研究結(jié)果,科興制藥已向美國食品藥品監(jiān)督管理局(FDA)提起臨床試驗(yàn)申請前會議(Pre-IND)申請。
據(jù)“科興制藥”微信公眾號介紹,SHEN26由科興生物制藥股份有限公司(688136.SH)全資子公司深圳科興藥業(yè)有限公司和深圳安泰維生物醫(yī)藥有限公司合作研發(fā)。
據(jù)介紹,SHEN26膠囊是一款廣譜、強(qiáng)效的新型冠狀病毒聚合酶(RdRp)抑制劑,對不同新冠病毒變異株(野生株、Alpha、Beta、Delta、Omicron)均有高效的體外抑制活性。對比瑞德西韋,體外抗病毒實(shí)驗(yàn)數(shù)據(jù)顯示,SHEN26膠囊對Omicron變異株的抑制活性是瑞德西韋的103倍;對比新冠口服藥物莫努匹韋,體內(nèi)藥效實(shí)驗(yàn)顯示,50mg/kg的SHEN26膠囊與200mg/kg的莫努匹韋抗新冠病毒效果相當(dāng),在被新冠病毒感染的小鼠模型中,SHEN26膠囊可顯著降低肺組織病毒滴度,改善肺部病變,對新冠病毒導(dǎo)致的組織損傷具有明顯的改善作用。在安全性測試方面,SHEN26膠囊存在脫靶副作用的風(fēng)險較低,遺傳毒性等研究結(jié)果為陰性,具有較高的治療指數(shù)和良好的安全性。
此外,SHEN26膠囊項(xiàng)目是國家科學(xué)技術(shù)部公共安全風(fēng)險防控與應(yīng)急技術(shù)裝備專項(xiàng)重點(diǎn)推動項(xiàng)目,并被列入2021年度廣東省防控新型冠狀病毒感染科技攻關(guān)應(yīng)急專項(xiàng)、廣東省藥品監(jiān)管局“三重”(生物醫(yī)藥產(chǎn)業(yè)重點(diǎn)項(xiàng)目、重點(diǎn)企業(yè)、重點(diǎn)地區(qū))創(chuàng)新項(xiàng)目。
臨床試驗(yàn)登記網(wǎng)站ClinicalTrials顯示,SHEN26的Ⅰ期臨床試驗(yàn)(NCT05504746)在安徽醫(yī)科大學(xué)第二醫(yī)院進(jìn)行,共招募86名參與者,旨在評估SHEN26膠囊在健康參與者中的安全性、耐受性和藥代動力學(xué)。
需要更加安全、廣譜的抗病毒藥物
“目前在研的這些藥物,多數(shù)最大的問題就是沒有具體的數(shù)據(jù),而很多已經(jīng)發(fā)布的數(shù)據(jù)是單一的,沒有可比性,所以很難對它們做出很科學(xué)客觀的評價。”丁勝說。
丁勝向澎湃科技解釋,對藥物分子的比較,需要多維度地進(jìn)行,單從一個指標(biāo)是看不出來的,例如,需要比較藥物的活性,在人體內(nèi)的代謝,藥物的有效性、毒副作用等。要大隊(duì)列地去比較,才能做出統(tǒng)一性的、有意義的回答。而就目前的情況來看,“多數(shù)藥物都沒有披露其結(jié)構(gòu)分子的數(shù)據(jù),很多藥物連Ⅰ期臨床試驗(yàn)的數(shù)據(jù)都沒有。只有以RdRp為靶點(diǎn)的幾個分子披露了結(jié)構(gòu)和一定的數(shù)據(jù)。由于數(shù)據(jù)沒有完全公開,所以沒有直接的可比性。”他說。
而這些在研的藥物究竟哪一款會更快上市,丁勝覺得,這是個未知數(shù)。“新藥研發(fā)這個事情,多有希望的分子都有可能失敗,對單一的藥物進(jìn)行可能性的判斷,不是特別容易。”
我們?nèi)匀恍枰碌男鹿诳共《舅幬铩!盁o論是在國際還是國內(nèi),過去三年,我們都看到這樣一個現(xiàn)象:對于感染而言,疫苗的保護(hù)效率沒有那么高。它僅僅是能夠降低重癥和死亡的可能性,但不能把重癥和死亡率降為0,新的突變株也極易產(chǎn)生免疫逃逸。感染后,有基礎(chǔ)病的人,特別是老年患者,更可能因新冠病毒的侵染而引發(fā)重癥。對這樣的患者,必須用藥物來治療,疫苗在這個時候已經(jīng)不管用了,不能在感染之后再去打疫苗。”丁勝說。
值得關(guān)注的是,我們需要的是什么樣的新冠抗病毒藥物?丁勝認(rèn)為,目前我們擁有的藥物,在感染早期使用,在有效性上是足夠的。因此在短期內(nèi),我們對新冠抗病毒藥物的需求是:同等有效但更安全,減少藥物間的相互作用(DDI, Drug-Drug Interaction),與此同時,若還能實(shí)現(xiàn)更高的有效性,當(dāng)然更好。
從長期的角度而言,前瞻地、預(yù)見性地開發(fā)廣譜抗病毒藥物,做好藥物研發(fā)儲備,才能在未來更好、更快地應(yīng)對全球性公共衛(wèi)生事件。“一款新藥的上市不是一蹴而就的,通常需要十年或更長的時間,如果總是滯后地研發(fā),我們面對突發(fā)性全球傳染病疫情時,在經(jīng)濟(jì)及生命安全上付出的代價將是巨大的。某一天或許又會出現(xiàn)一個像新冠這樣產(chǎn)生重大影響的病毒,有一些是可以預(yù)判的,有一些是完全未知的,所以我們要在已知的全球傳染病領(lǐng)域內(nèi)推進(jìn)相關(guān)藥物的研發(fā)及儲備。如果不持續(xù)投入,新冠疫情的困境可能又會重現(xiàn)。”丁勝說。
【新聞附件①】
對于新冠患者來說,小分子藥物有望成為最佳的治療手段。在新冠毒株不斷突變對中和抗體治療產(chǎn)生影響下,新冠小分子口服藥物有著不可比擬的優(yōu)勢:
(1)可作用于細(xì)胞內(nèi),包括細(xì)胞核內(nèi)靶點(diǎn)與細(xì)胞外的靶點(diǎn),靶點(diǎn)高度保守,不易發(fā)生耐藥性突變;
(2)大部分的小分子藥物可以口服,給藥方便(相比之下絕大部分的生物技術(shù)產(chǎn)品都采用注射類給藥方式,患者依從性差),可以用在門診輕癥患者身上,方便輕癥患者治療,包括感染后、暴露前、暴露后等治療;
(3)產(chǎn)能限制少,成本相對中和抗體等大分子藥較低;
(4)小分子藥物對儲存環(huán)境的敏感性相對較低,儲存和運(yùn)輸條件易滿足,普及性強(qiáng)。因此,小分子藥物有巨大的應(yīng)用前景和商業(yè)價值,成為新冠治療的關(guān)鍵手段。
【新聞附件②】
新冠小分子藥物總體上市情況目前,全球已有 6 款新冠口服藥上市。其中,在中國國內(nèi)獲批上市的可用于治療新冠病毒感染的抗病毒藥物已有三款,分別是輝瑞的Paxlovid(奈瑪特韋/利托那韋)、河南真實(shí)生物的阿茲夫定和默沙東的莫諾拉韋(Molnupiravir)。
(1)禮來和 Incyte 的巴瑞替尼(靶點(diǎn) :JAK):老藥新用。2021年7月28日,美國FDA修訂了巴瑞替尼(Baricitinib)的緊急使用授權(quán)(EUA),放寬使用條件,允許其單獨(dú)用于治療需要輔助供氧、無創(chuàng)或有創(chuàng)機(jī)械通氣或體外膜肺氧合(ECMO)的2歲以上新冠患者。針對重型或危重型患者,2022年9月,世界衛(wèi)生組織更新《COVID-19藥物治療動態(tài)指南》,推薦使用的藥物中包括了巴瑞替尼,可聯(lián)合糖皮質(zhì)激素、IL-6受體阻斷劑使用。
(2)吉利德科學(xué)的瑞德西韋(靶點(diǎn):RdRp,核苷類似物):分別于日本、歐洲、美國上市;
(3)默沙東的莫諾拉韋(靶點(diǎn):RdRp,核苷類似物):最早于 2021 年 11 月在英國獲批上市,隨后在日本上市、在美國獲批 EUA;2022年12月29日,獲得中國國家藥品監(jiān)督管理局應(yīng)急附條件批準(zhǔn)。
(4)輝瑞的 Paxlovid(靶點(diǎn):3CL):III 期數(shù)據(jù)顯示療效突出,已獲批美國 EUA,2021 年 12 月后分別在英國、歐洲、日本獲批上市,2022 年 2 月在中國獲批上市;
(5)河南真實(shí)生物的阿茲夫定(靶點(diǎn):RdRp):于 2022 年7 月獲得中國國家藥監(jiān)局通過優(yōu)先審評審批程序附條件批準(zhǔn)上市;
(6)鹽野義制藥的 Ensitrelvir(靶點(diǎn):3CL):于 2022年 11 月 22 日在日本獲批上市。已開始向中國國家藥監(jiān)局藥品審評中心(CDE)提交資料,準(zhǔn)備Ensitrelvir的新藥上市申請。
(編者注:以上新聞附件①、新聞附件②,均據(jù)清華大學(xué)醫(yī)院管理研究院《新冠小分子口服藥研究進(jìn)展》報告,最新進(jìn)展由澎湃科技根據(jù)公開資料更新整理。)





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯(lián)網(wǎng)新聞信息服務(wù)許可證:31120170006
增值電信業(yè)務(wù)經(jīng)營許可證:滬B2-2017116
? 2014-2025 上海東方報業(yè)有限公司




