- +1
“救命藥”加速到來!上海探索國外抗腫瘤新藥免臨床試驗進口
在上海,晚期腫瘤病人臨床急需藥,有望免臨床實驗通過正規渠道加速進口。
5月23日,國家藥品監督管理局、國家衛生健康委員會發布相關公告稱,對境外已上市的防治嚴重危及生命且尚無有效治療手段疾病的藥品,經研究認為不存在人種差異的,可提交境外取得的臨床試驗數據,直接申報藥品上市注冊申請。
5月24日,澎湃新聞(www.kxwhcb.com)記者從上海市食藥監局獲悉,上海已形成在指定醫療機構,定點先行使用國外已上市抗腫瘤新藥的試點工作方案,以及一系列風險控制措施。近日,這一試點方案將提交國家相關部門。
有人冒險通過“黑色渠道”搞到藥
國外抗腫瘤新藥進口時間漫長。
澎湃新聞記者采訪了解到,已在國外上市的抗腫瘤新藥,要在中國上市,必須得到國家藥品監管部門的審批,這個過程包括審評、審批多個環節,一般需要3到5年。
而長期以來,中國在藥品審評審批制度設計上存在短板,審批速度慢,大量申請積壓,加上人種的不同,此前國外臨床試驗數據完全不被認可,外國藥品即使已上市也要在中國重新進行臨床試驗,重復實驗,讓申請時間拉長。
業內透露,近10年來中國上市的一些典型國外新藥,上市時間平均比歐美晚5至7年,其中一些一上市就過時了。與此同時,國外藥企出于知識產權保護、市場策略等因素,短時間內不會把一些新藥在中國上市,這又導致在中國上市的新藥種類較少。
但病人等不起。
對于國外最新抗腫瘤藥,一些經濟實力強、有關系渠道的,就直接到國外就醫;另一些經濟條件可以承受,但對國外如何就醫知之不多、沒有關系的,就通過中介到國外治療。絕大多數患者缺乏去國外治療的經濟實力,就甘冒風險,通過各類購物網站、社交類網站及朋友圈等搞藥。這已經成為國外藥品進入中國的主要“黑色渠道”。按照相關法律規定,這些在國內沒有上市的進口藥,以假藥論處,不允許醫院和醫生用于臨床治療。
由于得不到有力有效監督,其中有不少假藥,有的甚至是在國內生產的冒牌國外新藥,給患者造成極大的經濟損失及生命隱患。
晚期腫瘤患者急需藥進口探索免臨床試驗可能
上海市食藥監局針對這個問題開展了深入研究。
由于事權劃分,該事項涉及藥監、衛生、海關、醫院等多個部門,需要各方的聯動協作推進。上海市食藥監局在前期研究的基礎上,形成在上海指定醫療機構定點先行使用國外已上市抗腫瘤新藥的試點工作方案和一系列風險控制措施,并先后赴市衛計委、仁濟醫院、上藥集團等相關單位深入開展專題研究,聽取各方建議和意見。
在調研中,上海市食藥監局發現現在的方案還存在這幾個問題:此類藥品未在國內上市,該如何定價?藥品在購進、運輸、儲存等環節由誰具體負責?該由誰來提出進口藥品申請?
經多部門反復研究探討,明確由醫療機構作為申請主體,上海市食藥監局聯合市衛計委,綜合醫院能級、醫療服務、質量管理水平和臨床使用經驗等因素,指定具備腫瘤專科特長的綜合性醫院和學科排名位于全國前列的科室作為指定試點單位。
上海市衛計委會同市食藥監局擬定具體品種目錄,在指定醫療機構,探索性地使用已被美國、歐盟、日本等地區的藥品監管機構批準上市,但在中國尚無同品種產品獲準注冊的國外抗腫瘤新藥,用于在現有診療規范下無更多可供選擇的治療手段的晚期腫瘤患者。
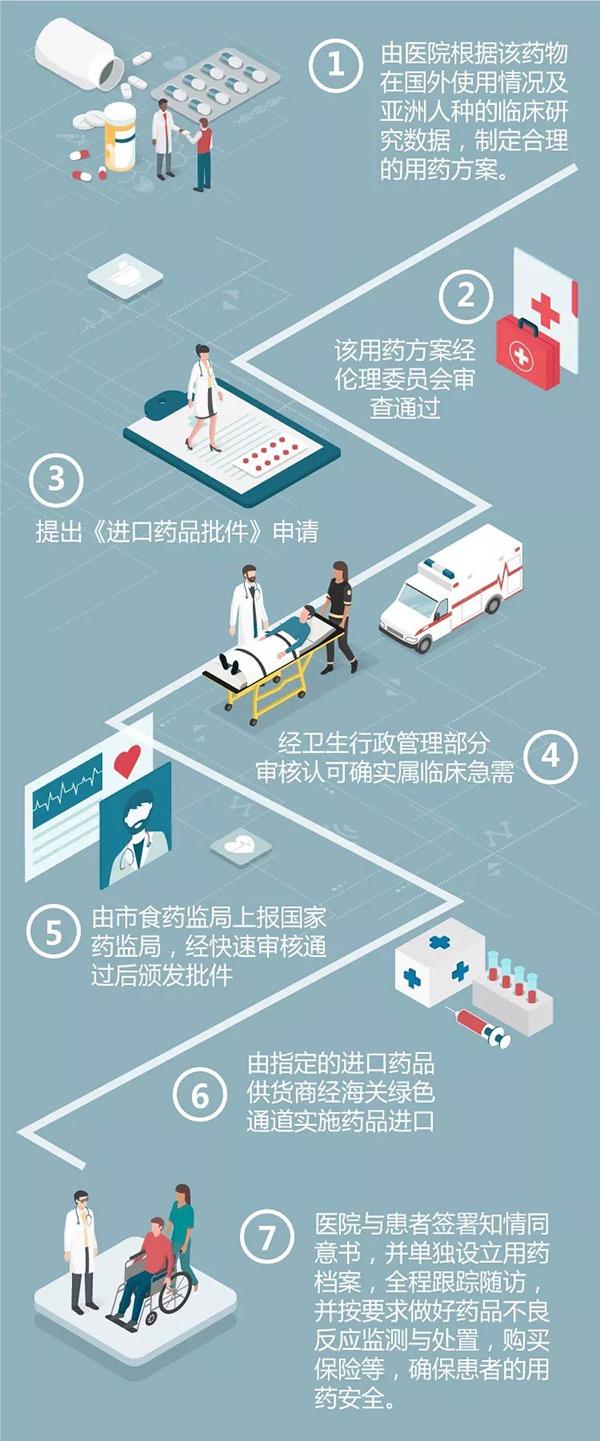
上海市食藥監局藥品注冊處處長張清介紹,上海試點方案的重點,一方面,盡可能讓許可流程縮短。另一方面,一些特例,比如臨床特別急需,而且沒有治療手段的危重的病人,可以免臨床實驗,直接申報藥品上市注冊申請,正規渠道用到進口新藥。
上海市食藥監局副局長陳堯水介紹,試點方案,擬在指定醫院、指定科室,由知道不良反應及風險點的醫生提出藥物清單。制定用藥方案,經倫理委員會審查通過后,提出申請。衛生行政管理部門快速審核通過后,經海關綠色通道進口。
目前,試點方案已編制完成,并于近日提交國家相關行政部門,等待審批。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業有限公司




