- +1
諾華回應基因療法Zolgensma早期論文被撤稿:對療效仍充滿信心
· 今年6月,Zolgensma臨床試驗在中國啟動。牽頭醫院方面認為,論文被撤稿有客觀原因,而對藥物臨床效用進行評價還為時過早。
諾華Zolgensma注射液。
諾華公司(Novartis)開創性基因替代療法Zolgensma,已在全球40多個國家獲批上市,被證明可用于治療脊髓性肌萎縮癥(SMA)。然而日前,為該療法奠定基礎的一篇臨床前早期研究論文,因數據不準確問題被《自然-生物技術》(Nature Biotechnology)雜志宣布撤回。據通告披露,接受治療的11只小鼠中,只有1只存活期超過250天,而不是原先所寫的6只。
對此,諾華公司向澎湃新聞(www.kxwhcb.com)回應稱,“諾華對其基因療法的療效和安全性仍充滿信心。迄今為止,來自多項研究的強大臨床數據資料和超過2300名患者的真實世界經驗證明了這一點。”
這篇論文題為《通過產后早期遞送SMN拯救小鼠模型中的脊髓型肌萎縮表型》,在線發表于2010年2月。通訊作者Brian Kaspar當時就職于俄亥俄州立大學,后來創辦了AveXis公司,研發出SMA基因療法AVXS-101(Zolgensma)。2018年,諾華以87億美元收購該公司,繼續改進該療法。
根據撤稿通知,論文作者去年提醒期刊注意論文中圖1e的不準確之處,這是一條Kaplan-Meier曲線,代表接受 scAAV9-SMN基因治療或對照接受scAAV9-GFP基因治療的脊髓性肌萎縮癥小鼠的存活率。今年,作者又提供了該圖的原始源數據文件,證實報告的小鼠壽命和實驗動物的入排存在多處不準確。“根據審稿人和編輯對數據的評估,我們認為圖 1e 和相關文本中的不準確程度破壞了對研究的充分信心。”
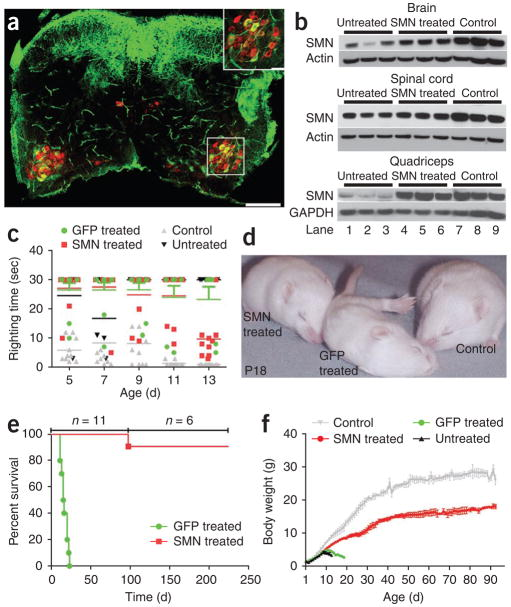
圖1e數據不準確,僅一只接受scAAV9-SMN基因治療的小鼠存活期超過250天。
“此研究發生在AveXis公司成立之前,該公司后來被諾華公司收購。在2021年得知源頭數據存在差異后,諾華向該論文的第一作者以及進行相關研究的學術機構通報了該出版物應該被更正或撤回。”諾華公司表示,由于諾華的申報材料中引用了該研究的部分數據,諾華向當時正在審核或批準Zolgensma材料的衛生當局通報了該情況。此外,諾華刪除了有關資料中對該出版物的提及與引用,并通知了外部相關方進行相同操作。
“作為出版商,我們的職責是評估我們發表的研究的穩健性并確保科學記錄的真實性。導致撤稿的期刊審查過程沒有解決可能的學術不端行為。”《自然-生物技術》發言人回應澎湃新聞稱,諾華公司沒有參與撤稿的決定,Zolgensma治療有效性的評估也與撤稿無關。
針對所有作者反對撤稿的理由,該發言人表示,“有關導致撤稿的期刊審查過程的詳細信息是保密的。”澎湃新聞記者同時聯系了上述論文的部分作者,截至發稿前未收到回復。
2019年5月,Zolgensma獲得美國FDA批準上市,用于治療2歲以下SMA患者。高達212.5萬美元的價格創下全球最貴藥品記錄,引發熱議。在此次新藥上市申請過程中,諾華也被指存在CMC(化學成分生產和控制)相關數據操控的爭議。
FDA方面認為,被篡改的數據可能影響一期臨床試驗結果,但似乎并不影響對動物毒理學研究或三期臨床試驗結果的解釋。雖然諾華直到產品獲批才通知FDA這一問題,但該問題幾乎不會阻礙Zolgensma最終獲批上市。諾華事后聲明稱,有問題的檢測方法僅用于初始產品測試,并未用在發布的商業化產品中。
此前獲批的SMA治療藥物Nusinersen和Risdiplam,均通過修飾SMN2的剪接來增加SMN蛋白的產量,需要連續給藥。而Zolgensma則是一種基因替代療法,通過腺相關病毒9型(AAV9)載體將人的SMN cDNA遞送到靶運動神經元細胞中,使其得以表達SMN蛋白,替換遺傳導致的SMN1基因功能缺損。它只需一次靜脈注射給藥,就有望阻止疾病進展,實現長期緩解甚至治愈。
2018年,脊髓性肌萎縮癥被列入國家第一批罕見病目錄。今年6月,作為全球III期臨床STEER研究的中國部分,Zolgensma(OAV101)臨床試驗在北京大學第一醫院正式啟動,面向2至18歲初治2型脊髓性肌萎縮癥。北京大學第一醫院相關工作人員表示,論文被撤稿有客觀原因,而對藥物臨床效用進行評價還為時過早,因而婉拒了澎湃新聞記者采訪。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業有限公司




