- +1
Life Med亮點 | 逆轉座子調控人類早期胚胎發育及疾病發生

人類基因組測序數據揭示,超過50% 的DNA序列由轉座元件(Transposable elements, TEs,又稱轉座子)所組成,其中反轉錄轉座子(以下簡稱為反轉座子)占絕對比例。顧名思義,反轉座子通過轉錄產生中間體RNA,進而被反轉錄形成新的DNA拷貝,整合進宿主基因組中(即 "復制-粘貼 "機制)。人類基因組主要包含長末端重復序列(long terminal repeat,LTR)、非長末端重復序列(non-long terminal repeat,non-LTR)和SINE-VNTR-Alu(SVA)序列等三種類型的反轉座子。其中,LTR反轉座子或內源性逆轉錄病毒(endogenous retrovirus,ERV)起源于外源逆轉錄病毒的侵染。在數千萬年的進化過程中,ERV逐漸被固定下來,成為宿主基因組的一部分(大約占人類基因組的8%)。另一方面,non-LTR序列,包括LINE和SINE,大約占人類基因組的30%。LINE-1 (L1) 是一類自主性反轉座子,能夠表達一整套負責轉座的蛋白機器。相比之下,作為類人猿所特有的一種非自主性反轉座子,SVA 可以利用 L1 元件產生的蛋白機器來實現轉座。絕大多數反轉座子由于序列突變或受表觀調控而處于轉錄沉默狀態,因此長期以來被稱認為是“無用DNA”或“化石DNA”。近年來,得益于多組學測序及基因組編輯技術的發展,越來越多的證據表明,這些所謂的“無用DNA”可能對人類發育和健康至關重要。
逆轉座子調控人類早期胚胎發育
在進化過程中,ERV 不同程度地保留了其祖先外源病毒的原始特征。其中,某些對宿主發育及健康有利的ERV元件被馴化或共選擇下來,成為宿主基因組的必要部分。例如,由 HERV 包被膜基因(如 HERVW-1、HERV-FRD1)所編碼的合胞素(如Syncytin-1,-2)在人類胎盤合胞體滋養層形成過程中起著重要作用。此外,作為進化上最為年輕的ERV, HERVK(HML-2)可通過表達附屬蛋白 Rec來促進人類植入前胚胎的抗病毒免疫反應。此外,LTR為人類早期胚胎發育過程中的基因表達提供了豐富的順式調控元件,如增強子、啟動子及poly A位點等。多種靈長類/類人猿特異性反轉座子在人類胚胎植入前發育過程中被階段特異性地重新激活,表明這些反轉座子參與構建人類早期胚胎發育的基因調控網絡。此外,LTR5_Hs 元件(即 HERVK 的末端調控序列)還被發現可作為增強子促進人類原始生殖細胞的特化,表明其在人類生殖細胞發育中的發揮重要作用。
特別是,利用微量細胞ChIP-seq或cut&run技術,研究人員揭示了H3K9me3修飾調控人類著床前胚胎發育的重要功能。研究表明,特定的KRAB-ZNFs蛋白可通過發育階段特異性的H3K9me3修飾來調節不同LTR家族的轉錄。其中,在人類胚胎二細胞(2C)發育到八細胞(8C)期間,H3K9me3在類人猿特異性SVA_D反轉座子上的沉積減少,有利于這些反轉座子與合子基因組激活(ZGA)相關基因相互作用。進一步研究發現,SVA_D逆轉座子可充當增強子為8C關鍵轉錄因子(如DUXA和ZSCAN4)提供結合位點來促進人類的ZGA。的確,SVA_D元件的表達沉默可阻礙ZGA和囊胚形成,揭示了SVA_D在人類著床前胚胎發育中的重要功能。此外,在胎盤滋養層中,H3K9me3的從頭沉積可阻止多能性轉錄因子與某些類人猿特異性反轉座子結合,抑制ICM譜系相關基因表達,表明H3K9me3重編程對人類胚胎早期譜系特化具有潛在促進作用。反轉座子是否參與調控人類著床后胚胎中的譜系特化和胚層分化,有待于以后進一步研究。
逆轉座子參與人類疾病發生
在正常生理條件下,轉座子的轉錄活性受到人類基因組監控系統的嚴格控制,而在病理或衰老條件下則有可能發生失調。例如,人類特異性HERVK(HML-2)被報道廣泛參腫瘤發生、衰老以及抗病毒先天免疫反應等多個生理過程。其中,HERVK(HML-2)在神經發育中的作用尤其引人關注。最近,一項研究基于人類多能干細胞模型,結合CRISPR-VPR系統,發現 HERVK(HML-2)的異常激活可誘導神經元分化相關基因的過早表達,進而損害皮質神經元的發育,推測HERVK的異常激活可能與神經系統發育異常及神經退行性疾病有關。此外, HERV-K(HML-2)的多個拷貝具有完整的開放閱讀框,可在某些病理過程及衰老細胞中產生逆轉錄病毒樣顆粒(RVLPs)。然而,這些HERVK衍生的RVLPs是否以及如何調節腫瘤發生或衰老還有待進一步回答。
反轉座子LINE-1(L1)在衰老及免疫反應過程中的作用近期也得到了廣泛關注。研究發現, BMAL1可通過穩定異染色質,進而抑制L1-cGAS-STING途徑的激活來防止干細胞衰老,推測L1轉錄本可通過促進IFN-I介導的先天免疫信號驅動細胞衰老。有趣的是,有研究表明,L1轉錄本的表達有助于維持新生CD4+T細胞的靜止狀態。同時,在功能失調的T細胞中也觀察到 L1的異常轉錄,提示其在調控T細胞衰竭方面具有潛在功能。
值得注意的是,作為人類基因組中唯一自主性轉座元件,L1轉座可能會誘發插入性誘變。一項研究通過泛癌基因組分析發現,近一半的人類癌細胞系表現出體細胞L1轉座活性,提示L1轉座可能通過引起基因功能缺失而促進腫瘤發生。有趣的是,同時有研究卻揭示L1在抑制腫瘤進展方面具有潛在作用。HUSH復合體的組成蛋白MPP8被證明在骨髓性白血病中參與抑制L1,而L1的重新激活則會抑制腫瘤細胞生長。這些表明L1的轉座活性具有腫瘤類型特異性。
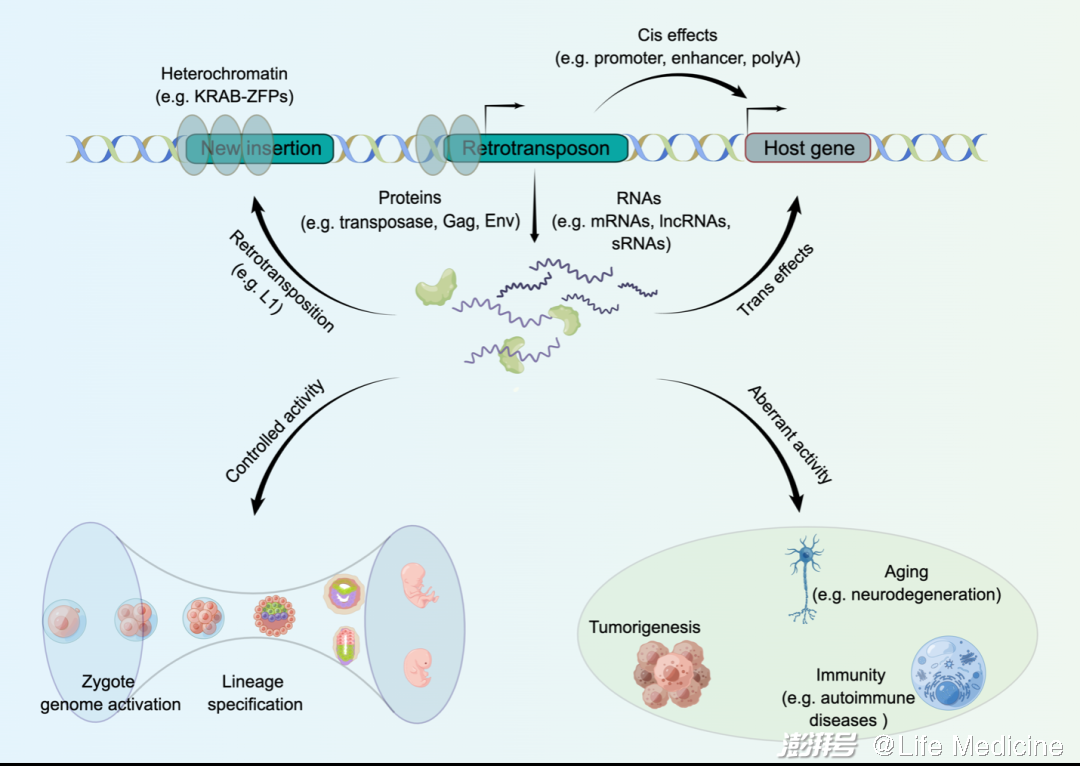
總的來說,最新的一系列研究進一步證實,在正常生理條件下,反轉座子的轉錄激活參與調控人類早期胚胎發育,而其在體細胞中的異常激活則與疾病發生和衰老密切相關,這強調了基因組監控系統的重要性。事實上,像其他真核生物一樣,人類已經進化出一套高度協調的分子機制來控制反轉座子的轉錄活性,包括PIWI/piRNA途徑、KRAB-ZFP-KAP1復合體、DNA甲基化、組蛋白修飾及RNA修飾等。盡管反轉座子在人類衰老、神經退行性疾病、免疫炎癥和癌癥等過程中存在廣泛影響,但其背后的因果聯系及分子機制還相當模糊。基因編輯和三代測序技術將為有助于進一步破譯反轉座子在早期發育和疾病中的多重角色。
原文鏈接:https://doi.org/10.1093/lifemedi/lnac041
本文為澎湃號作者或機構在澎湃新聞上傳并發布,僅代表該作者或機構觀點,不代表澎湃新聞的觀點或立場,澎湃新聞僅提供信息發布平臺。申請澎湃號請用電腦訪問http://renzheng.thepaper.cn。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業有限公司




