- +1
百萬一針抗癌神藥CAR-T銷量如何?有藥企上半年開出77張處方
半年報收官,三家國內企業不同程度公布了“抗癌神藥”CAR-T療法相關業績。
8月30日晚間,藥明巨諾(02126.HK)公布2022上半年業績,顯示上半年營收6600萬元。目前,藥明巨諾僅有一款商業化產品,即靶向CD19自體CAR-T細胞免疫治療產品倍諾達。2021年9月,該產品獲批上市,用于治療經過二線或以上系統性治療后成人患者的復發或難治性大B細胞淋巴瘤,成為中國首個獲批為1類生物制品的CAR-T產品。
半年報顯示,上半年,公司開具了77張倍諾達處方,完成64位患者的回輸。醫院數量方面,公司在中國83家醫院完成了培訓、試運行及評估,并認證該等醫院合資格使用倍諾達。
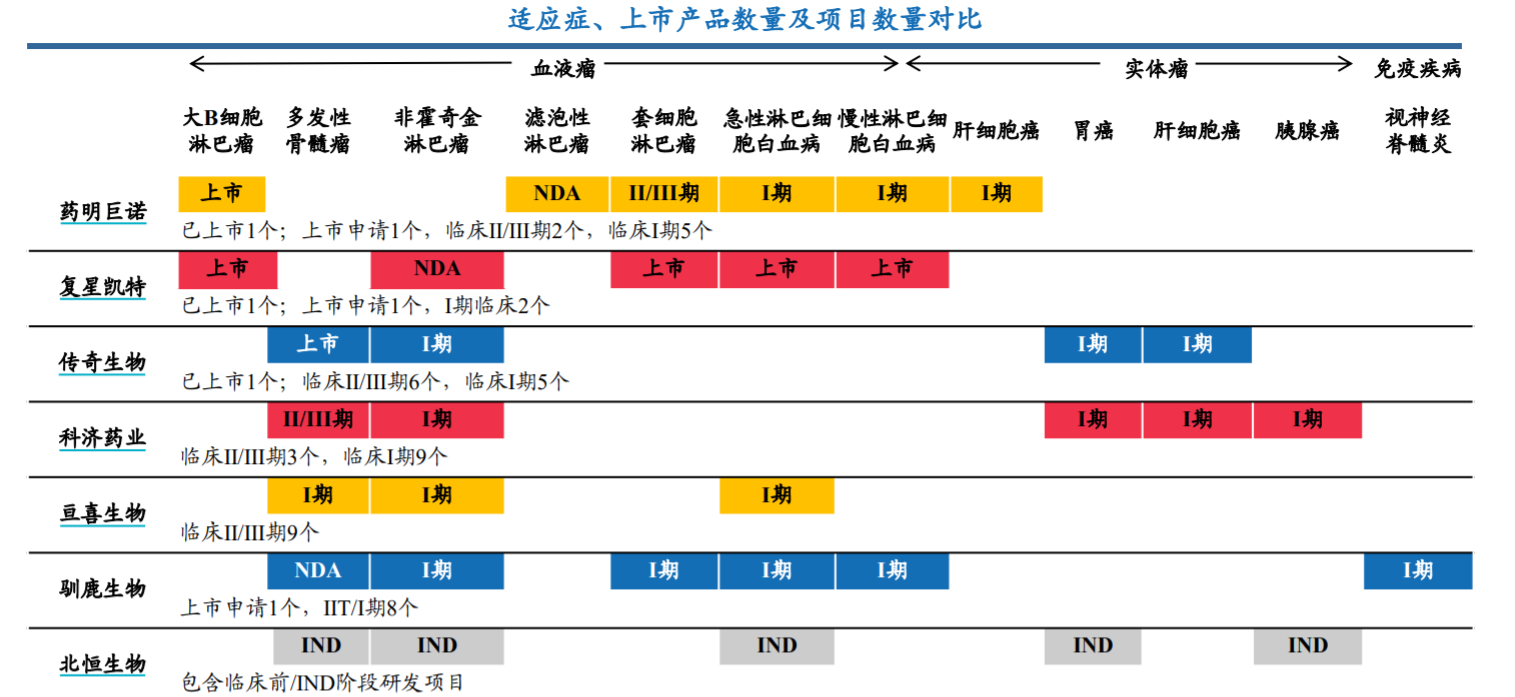
CAR-T療法各企業適應證、上市產品、項目對比 來源:華安證券研報
在藥明巨諾CAR-T產品獲批之前,2021年6月,復星凱特的阿基侖賽注射液(商品名:奕凱達)也獲批,是國內首個獲批上市的CAR-T細胞治療產品。復星凱特是復星醫藥的合營公司,復星醫藥半年報并未披露這款產品具體使用的患者人數,不過提到,截至2022年7月末,備案的治療中心達近百家。一季報則顯示,截至今年2月末,已有約百名患者進入治療流程,備案的治療中心有75家。
復星醫藥董事長吳以芳在8月30日下午的業績會上提到,今年上半年散發的疫情對整個醫療板塊影響還是比較大的,公司在上海的企業在生產制造時遇到一些情況,尤其是CAR-T。
按照藥明巨諾和復星醫藥公布的數據,不考慮重疊醫院的可能,目前兩款在國內獲批的CAR-T產品覆蓋醫院數量近200家。
除了上述兩款已經在國內獲批的產品,金斯瑞生物旗下的傳奇生物(NASDAQ: LEGN)也有一款CAR-T療法,今年2月末,傳奇生物宣布,該療法在美國獲批,是首款獲得FDA批準的國產CAR-T細胞療法,也是全球第二款獲批上市的BCMA靶向CAR-T療法。
7月21日,金斯瑞生物科技曾公告稱,其非全資附屬公司傳奇生物旗下CAR-T產品CARVYKTI截至2022年6月30日,季度產生貿易銷售凈額約2400萬美元,約1.62億元。
商保等創新支付方式推動CAR-T可及性
CAR-T療法屬于細胞免疫療法,是在體外利用基因工程的方法修飾患者外周血T細胞,賦予T細胞靶向識別腫瘤細胞表面抗原的特性 ,經體外擴增培養后回輸到患者體內進行治療腫瘤的方法。
由于治療潛力巨大,且有治愈腫瘤的可能,有人稱之為“抗癌神藥”,但同時,由于屬于定制化療法,該療法的價格也頗為昂貴,未經報銷的價格達到百萬元級別,如何推進CAR-T療法的可及性,成為包括企業在內的各方關注的問題。
復星醫藥在半年報中提到,截至2022年7月末,已列入44個省市的城市惠民保和超過50項商業保險。吳以芳在業績會也提到,對于既往沒有的,現在有創新支付的城市,能夠報銷相對30%以上的比例,不同的城市可能有不同,但是現在最低也沒有低于30%,很大程度上解決了患者的負擔。公司也在CAR-T的生產技術上進行持續的改進,不斷優化生產和技術,希望能夠盡可能降低成本,服務于更多患者。
藥明巨諾方面,截至2022年6月30日,倍諾達已被列入52個商業保險產品及28個地方政府的補充醫療保險計劃,有12名患者自該等保險計劃獲益。藥明巨諾還提到,公司將繼續與創新支付平臺合作,這些公司能夠向以倍諾達作為治療手段的潛在接受者提供分期付款服務或抵押貸款。同時,將繼續加強多層級醫療保障體系,減輕合資格接受倍諾達治療的患者的負擔。
此外,藥明巨諾還提到,截至2022年8月,公司已經建立了一個由100名左右不同專業的員工組成的商業團隊,涵蓋銷售團隊、市場團隊、CAR-T顧問團隊、創新支付團隊、渠道管理和醫院準入團隊。這些團隊均由經驗豐富的商業領袖帶領, 且具備清晰的商業模式。

各家CAR-T療法企業靶點對比 來源:華安證券研報
多款CAR-T療法在研
從國際市場來看,CAR-T療法的市場潛力巨大。以跨國藥企百時美施貴寶(BMS)為例,旗下擁有兩款已上市的CAR-T藥物。半年報顯示,Abecma半年銷售額1.56億美元,較去年同期的0.24億美元增長550%;Breyanzi上半年銷售額0.83億美元,較去年同期0.17億美元增長388%。
在CAR-T療法的賽道,除了已經實現商業化的國產CAR-T產品,科濟藥業(2171.HK)、馴鹿生物、亙喜生物等多家藥企也在推進CAR-T相關研發,如科濟藥業在半年報披露,CAR-T產品CT053計劃于2022年第三季度向國家藥品監督管理局提交新藥申請,并計劃于2023年向美國食品藥品監督管理局提交生物藥物上市許可申請。
8月20日,馴鹿生物宣布,國家藥品監督管理局審評中心已正式審批通過其全人源BCMA嵌合抗原受體自體T細胞注射液新增擴展適應癥抗體介導的視神經脊髓炎譜系疾病的臨床試驗申請。今年6月,該藥治療復發/難治性多發性骨髓瘤的新藥上市申請獲國家藥品監督管理局正式受理并納入優先審評。
華安證券研報提出,CAR-T技術平臺與研發進展是各公司的核心競爭力,重點關注CAR-T技術平臺先進、研發管線靠前、擁有差異性競爭優勢的CAR-T公司。海通國際研報也指出,現有適應證競爭激烈、靶點集中(CD19、BCMA等),Biotech需要在紅海市場中具有明顯優勢或者通過核心技術突破進入藍海市場。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業有限公司




