- +1
Light | 光纖顯微內(nèi)窺鏡:癌細胞三維成像
注:本文由課題組供稿
| 導(dǎo)讀 |
世界衛(wèi)生組織預(yù)估數(shù)據(jù)顯示2020年全球因癌癥死亡病例近一千萬例,其中我國約占300萬例。研究顯示,癌癥早發(fā)現(xiàn)、早治療能顯著提高患者的生存率。然而,因為癌癥早期病灶太小,準(zhǔn)確對癌癥進行早診斷并定位病變位置常常比較困難。
內(nèi)窺鏡成像是癌癥臨床診斷的常見方法之一,但常規(guī)內(nèi)窺鏡的放大倍率只有大約50倍,只能看清組織大概的形貌。經(jīng)常需要先對“疑似病變”組織進行穿刺取樣,再對組織染色,最后由病理醫(yī)生使用顯微鏡判斷組織是否癌變,流程繁瑣且不利于早期治療。
圖1. 常規(guī)內(nèi)窺鏡直徑至少幾十毫米,且放大倍率只有大約50倍。(圖源:Light新媒體/VEER)
近日,德國德累斯頓工業(yè)大學(xué)電子信息學(xué)院測量和傳感器系統(tǒng)技術(shù)實驗室聯(lián)合清華大學(xué)、德國馬克斯·普朗克光科學(xué)研究所的研究團隊合作提出一種新型無透鏡光纖顯微內(nèi)窺鏡成像技術(shù)。這種新型內(nèi)窺鏡只有繡花針般大小,卻有著1000倍的超高放大倍率,可以讓醫(yī)生“看清”組織表面細胞的同時,極大減輕患者的痛苦。
該文章近日發(fā)表在Light: Science & Applications,題為“Quantitative phase imaging through an ultra-thin lensless fiber endoscope”。
來自德國德累斯頓工業(yè)大學(xué)的助理研究員孫佳偉為論文的第一作者和共同通訊作者,Juergen Czarske教授和Nektarios Koukourakis博士為論文的共同通訊作者。該工作得到清華大學(xué)曹良才教授、德國馬克斯·普朗克光科學(xué)研究所Jochen Guck教授的指導(dǎo)。

在目前臨床實踐中,常規(guī)內(nèi)窺鏡可以實時對患者體內(nèi)的組織進行成像觀察,輔助醫(yī)生進行診斷,在縮短診斷周期的同時,還能避免因采樣造成的器官損傷。常規(guī)的內(nèi)窺鏡直徑從幾十毫米到幾厘米不等,但放大倍率通常只有50倍,只能看清組織大概的形貌特征,而且將如此粗的常規(guī)內(nèi)窺鏡伸進患者體內(nèi)往往會帶來痛苦的體驗。
而最新的光纖顯微內(nèi)窺鏡的確可以通過共聚焦掃描實現(xiàn)體內(nèi)顯微成像,但需要昂貴的光學(xué)系統(tǒng)和復(fù)雜的校準(zhǔn)流程。且為了提升圖像的分辨率,需要對體內(nèi)組織進行特殊熒光染色,但熒光劑對人體有一定的毒性,而且不易去除,因此無需染色的高對比度成像技術(shù)對內(nèi)窺鏡尤其重要。
定量相位成像(Quantitative phase imaging)技術(shù)常被用于對未染色的生物醫(yī)學(xué)樣品進行高對比度成像,而且通過重建光場的相位信息還能實現(xiàn)三維成像。由于定量相位成像能達到納米級的軸向分辨率,還常常還被用于芯片表面檢測。最新的研究還發(fā)現(xiàn)使用定量相位成像能動態(tài)檢測出血液中的新冠病毒,有望提升實驗室病毒檢測的速度。
然而,目前的定量相位成像技術(shù)大多基于龐大笨重的顯微鏡平臺。在癌癥的臨床診斷中,經(jīng)常需要一系列復(fù)雜的手續(xù)來判斷組織是否發(fā)生癌變。因此,如果能將定量相位成像技術(shù)應(yīng)用到內(nèi)窺鏡中,將能極大地簡化診斷流程,而且還能避免熒光劑對人體帶來的損害。
為解決傳統(tǒng)內(nèi)窺鏡系統(tǒng)帶來的弊端,該組研究人員發(fā)明了一種新型的無透鏡光纖顯微內(nèi)窺鏡系統(tǒng),并首次通過無透鏡光纖內(nèi)窺鏡實現(xiàn)定量相位成像。
該系統(tǒng)使用多芯光纖(Multi-core fiber)作為超細體內(nèi)成像探針,而多芯光纖是一種約三根頭發(fā)絲粗的光線束,由一萬根單模光纖芯組成。由于沒有在探測端使用任何透鏡和光學(xué)元件,整個探針最粗的地方也只有0.35毫米(見圖2),能夠極大地減少因常規(guī)內(nèi)窺鏡成像給患者帶來的痛苦和創(chuàng)傷。

圖2. 新型無透鏡光纖顯微內(nèi)窺鏡與1歐元硬幣對比,直徑僅為0.35毫米。(圖源:Light: Science & Applications (2022) 11:204 Fig. 1)
然而,目前的無透鏡內(nèi)窺鏡只能對光纖表面進行成像,就算物體距離光纖表面只有1毫米,成像的質(zhì)量也會大幅降低。另外,由于一萬根單模光纖芯的相位差各不相同,相當(dāng)于把測量物體的相位信息進行了“加密”,想要完整地通過無透鏡內(nèi)窺鏡實現(xiàn)相位成像非常具有挑戰(zhàn)性。
為了解決上述問題,研究人員提出了一種新的重建算法,通過把測量物體的相位信息從接收端遠場的散斑中“解碼”出來,從而進一步獲得光纖另外一端的光場信息。實現(xiàn)了利用一張圖像進行數(shù)字重聚焦,把無透鏡光纖顯微內(nèi)窺鏡的工作距離從10微米以內(nèi)顯著提升到了10毫米,并首次通過無透鏡光纖內(nèi)窺鏡實現(xiàn)定量相位成像。這種全新顯微內(nèi)窺鏡的放大倍率可以達到1000倍,最小可以“看清”1微米的物體,并實現(xiàn)納米級的三維重建。
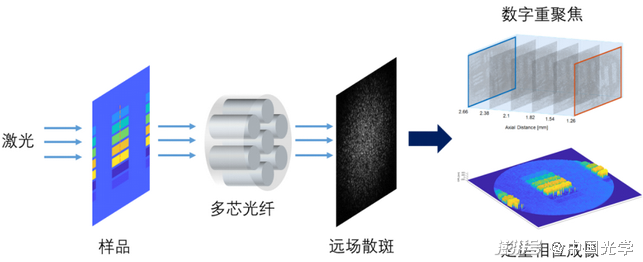
圖3. 新型無透鏡光纖顯微內(nèi)窺鏡成像原理,通過重建遠場散斑實現(xiàn)數(shù)字對焦和三維成像。(圖源:論文作者)
●數(shù)字重聚焦(Digital refocusing)
數(shù)字重聚焦是指利用算法,將一張含有光場信息的二維圖片,后期重建出不同深度的二位切片,從而實現(xiàn)對物體重新對焦。而光場信息由幅度和相位信息組成,包含了空間的三維信息。在這項研究中,研究人員利用光纖接收端遠場的散斑重建出光纖測量端的幅度和相位信息,進而組合為光場信息,借助算法便可進一步重建出不同深度上的幅度和相位圖像。有了這項技術(shù),醫(yī)生便不再需要手動調(diào)整內(nèi)窺鏡的焦距,通過算法便可實現(xiàn)實時數(shù)字對焦,提升了光纖顯微內(nèi)窺鏡的易用性,拓寬了其應(yīng)用場景。
而定量相位成像作為一項納米級精密成像技術(shù),對相位重建的準(zhǔn)確性有非常高的要求。為了驗證相位重建的準(zhǔn)確性,研究人員使用光纖顯微內(nèi)窺鏡對一個最小光程差只有80納米的測試板進行定量相位成像。實驗很好地重建出了樣品的納米級三維結(jié)構(gòu),即使是軸向上80納米光程差的結(jié)構(gòu)也能很準(zhǔn)確地重建出來。
為了進一步測試該新型光纖顯微內(nèi)窺鏡對生物樣品的成像能力,研究人員對未染色的宮頸癌細胞進行了體外成像測試。由于該類癌細胞大多無色透明,所以通常會先對要觀察的細胞進行熒光染色,以增加顯微鏡圖像的對比度。然而,熒光劑對人體有一定的毒性,而且不易去除,所以臨床上在使用內(nèi)窺鏡進行體內(nèi)成像的時候,一般不會對體內(nèi)組織進行熒光染色。既然不能給體內(nèi)組織染色,而癌細胞又無色透明,那如何提升光纖顯微內(nèi)窺鏡的對比度呢?
研究人員利用定量相位成像來提升圖像的對比度,并模擬出熒光染色成像效果,使癌細胞可以從復(fù)雜的背景中被清晰地分辨出來。圖4為通過無透鏡光纖顯微內(nèi)窺鏡觀察到的正在分裂中的宮頸癌細胞。另外值得注意的是,細胞體積、折射率、干質(zhì)量等重要物理參數(shù)也可以從定量相位重建圖中計算出來,用以輔助臨床診斷和研究。
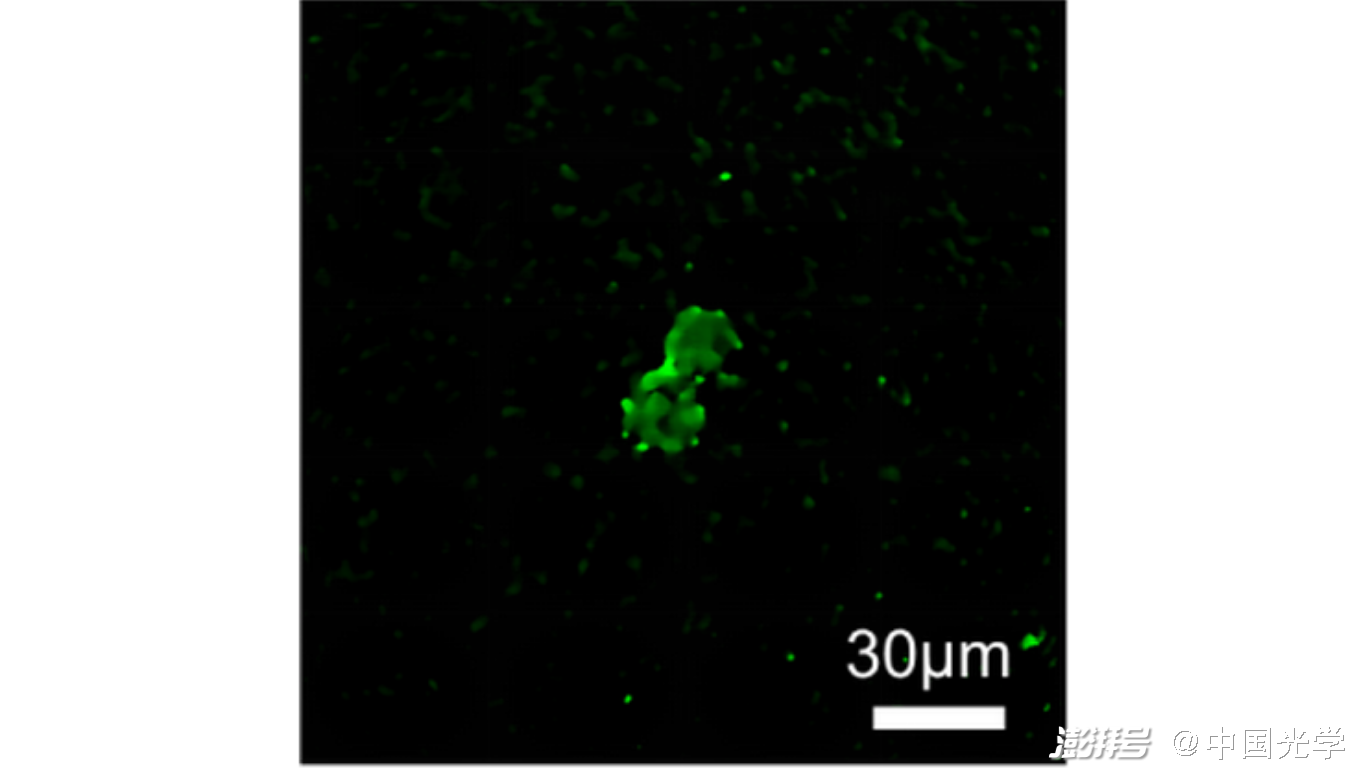
圖4. 由無透鏡光纖顯微內(nèi)窺鏡拍攝的定量相位圖。圖中為正在分裂中的宮頸癌細胞(HeLa cell),比例尺為30微米。(Light: Science & Applications (2022) 11:204 Fig. 6)
上述實驗成功實現(xiàn)對體外癌細胞的成像,這就意味著這種新型無透鏡光纖顯微內(nèi)窺鏡有望進一步對體內(nèi)組織進行高分辨率成像,將在癌癥的預(yù)警和早期診斷與研究中發(fā)揮重要作用。與此同時,這種只有繡花針大小的內(nèi)窺鏡,在極大減輕患者痛苦和創(chuàng)傷的同時,還能深入體內(nèi)非常狹窄的部位進行顯微成像,如耳蝸、微血管、肺泡等。
未來通過提升重建算法的效率,可以進一步提升成像速度,甚至有望實現(xiàn)實時高分辨率成像。作為一種高分辨率且低成本的微型內(nèi)窺鏡成像技術(shù),無透鏡光纖顯微內(nèi)窺鏡或?qū)⒃谖磥淼呐R床診斷中大顯身手。
| 論文信息 |
Sun, J., Wu, J., Wu, S. et al. Quantitative phase imaging through an ultra-thin lensless fiber endoscope. Light Sci Appl 11, 204 (2022).
https://doi.org/10.1038/s41377-022-00898-2
監(jiān)制:趙陽
編輯:趙唯
本文為澎湃號作者或機構(gòu)在澎湃新聞上傳并發(fā)布,僅代表該作者或機構(gòu)觀點,不代表澎湃新聞的觀點或立場,澎湃新聞僅提供信息發(fā)布平臺。申請澎湃號請用電腦訪問http://renzheng.thepaper.cn。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯(lián)網(wǎng)新聞信息服務(wù)許可證:31120170006
增值電信業(yè)務(wù)經(jīng)營許可證:滬B2-2017116
? 2014-2025 上海東方報業(yè)有限公司




