- +1
中國生命科學(xué)研究新突破:化學(xué)小分子完整逆轉(zhuǎn)人體細胞“發(fā)育時鐘”
如何逆轉(zhuǎn)細胞命運?這個問題在科學(xué)界已經(jīng)研究了幾十年之久,然而截至目前,科學(xué)家仍在尋求一種更為簡單、精準、安全并可以應(yīng)用于臨床的技術(shù)。
北京時間4月13日23時,頂級學(xué)術(shù)期刊《自然》(Nature)在線發(fā)表了北京大學(xué)博雅講席教授、干細胞研究中心主任鄧宏魁團隊的一項最新研究,題為“化學(xué)重編程人類成體細胞為多能干細胞”( Chemical reprogramming of human somatic cells to pluripotent stem cells)。這項突破性研究成果首次在國際上報道了使用化學(xué)小分子誘導(dǎo)人成體細胞轉(zhuǎn)變?yōu)槎酀撃芨杉毎瑢崿F(xiàn)了人體細胞發(fā)育過程的“大逆轉(zhuǎn)”。

鄧宏魁在接受澎湃新聞(www.kxwhcb.com)記者專訪時表示,“我們一直在追求一種更加簡單、精準和可控的方法,不涉及任何復(fù)雜操作,僅僅在細胞培養(yǎng)基中添加一些特定的外源化學(xué)小分子,就能控制細胞的特性,甚至逆轉(zhuǎn)發(fā)育特征。”他認為,這種“最簡單”的操控細胞命運的方式,卻可以帶來質(zhì)的飛躍。
渦蟲、蠑螈等低等動物擁有超強的再生能力,而人在進化過程中喪失了這種能力。顯而易見的一點是,在老齡化日趨嚴重的當(dāng)下,“一個關(guān)鍵的社會問題是我們能不能實現(xiàn)健康的老齡化?”包括鄧宏魁在內(nèi)的該領(lǐng)域科學(xué)家認為,提升人的再生能力,能為解決衰老過程引起而目前傳統(tǒng)醫(yī)學(xué)不能解決的重大疾病提供一種新的手段。
該領(lǐng)域朝著這一目標的嘗試已經(jīng)歷了幾十年。上世紀60年代,英國科學(xué)家約翰·戈登(John Gurdon)在爪蟾中開發(fā)了細胞核移植技術(shù);1997年,英國Roslin研究所的伊恩·維爾穆特(Ian Wilmut)團隊利用該技術(shù)制備了克隆羊“多莉”,證明了哺乳動物高度分化的體細胞可以被逆轉(zhuǎn)為早期胚胎的初始狀態(tài),并獲得了發(fā)育為整個動物個體的能力。2006年,日本科學(xué)家山中伸彌(Shinya Yamanaka)報道了使用轉(zhuǎn)基因的方式可以將小鼠成體細胞重編程為多潛能干細胞,被稱為誘導(dǎo)多潛能干細胞(iPS細胞)。
鄧宏魁等人的化學(xué)重編程方法是繼上述“細胞核移植”和“轉(zhuǎn)錄因子表達”之后的新一代的、由我國自主研發(fā)的人多潛能干細胞制備技術(shù),同時解決了我國干細胞和再生醫(yī)學(xué)的發(fā)展中底層技術(shù)上的“瓶頸”問題。

鄧宏魁團隊在細胞重編程和干細胞研究領(lǐng)域深耕了十幾年。此前的2013年,其團隊在頂級學(xué)術(shù)期刊《科學(xué)》(Science)發(fā)表了一項原創(chuàng)性的研究成果,即不依賴細胞內(nèi)源物質(zhì),僅使用外源性化學(xué)小分子就可以逆轉(zhuǎn)細胞命運,將小鼠的體細胞重編程為多潛能干細胞(CiPS細胞)。將類似的方法推衍到人類細胞上,他們又整整走了9年時間。
經(jīng)過長期堅持和探索,鄧宏魁團隊突破了人類成體細胞化學(xué)重編程的瓶頸問題。破題思路仍然來源于低等動物,“它們是怎么實現(xiàn)再生的?”鄧宏魁談到,團隊回到了這一本質(zhì)問題。蠑螈等低等動物在受到外界損傷后其體細胞會自發(fā)的改變本身的特性,進而通過被稱為“去分化”的過程獲得一定的“可塑性”,借助這一可塑的中間狀態(tài)從而實現(xiàn)肢體的再生。
研究團隊假設(shè),重新建立這種可塑狀態(tài)是小分子解鎖人類體細胞“身份”,并允許生成人多潛能干細胞的關(guān)鍵。受此啟發(fā),研究團隊把工作主要分成了兩個步驟。“第一步不是實現(xiàn)多潛能干細胞,而是去模擬低等動物這條路,如果第一步實現(xiàn)了,后面一步實現(xiàn)多潛能干細胞可能就很容易了。”在鄧宏魁看來,第一步是真正具有跨越意義的一步,“這或可以真正打開人類再生醫(yī)學(xué)的大門。”
沿著上述思路,研究團隊進行了大量化學(xué)小分子的篩選和組合,最終發(fā)現(xiàn)高度分化的人成體細胞在特定的化學(xué)小分子組合的作用下,同樣可以發(fā)生類似低等動物中去分化的現(xiàn)象,并獲得具有一定可塑性的中間狀態(tài)。在此基礎(chǔ)上,研究團隊最終實現(xiàn)了人CiPS細胞的成功誘導(dǎo)。
總體而言,他們通過創(chuàng)造一個中間的可塑性狀態(tài)來實現(xiàn)人類體細胞的化學(xué)重編程,并獲得了和胚胎干細胞高度相似的人CiPS細胞。整個化學(xué)重編程軌跡分析揭示了早期中間塑性狀態(tài)的產(chǎn)生,在此過程中發(fā)生化學(xué)小分子誘導(dǎo)的細胞去分化現(xiàn)象。比對分析發(fā)現(xiàn),該過程與蠑螈肢體再生的去分化過程相似,激活了與發(fā)育和再生相關(guān)的關(guān)鍵基因。
更重要的是,研究團隊還發(fā)現(xiàn)了調(diào)控這一類再生過程和細胞可塑性的關(guān)鍵信號通路,即JNK通路是化學(xué)重編程的主要障礙,抑制JNK通路對于通過抑制炎癥信號來誘導(dǎo)細胞可塑性和再生相關(guān)程序是必不可少的。因此,JNK通路可能成為研究人類再生的新靶點。
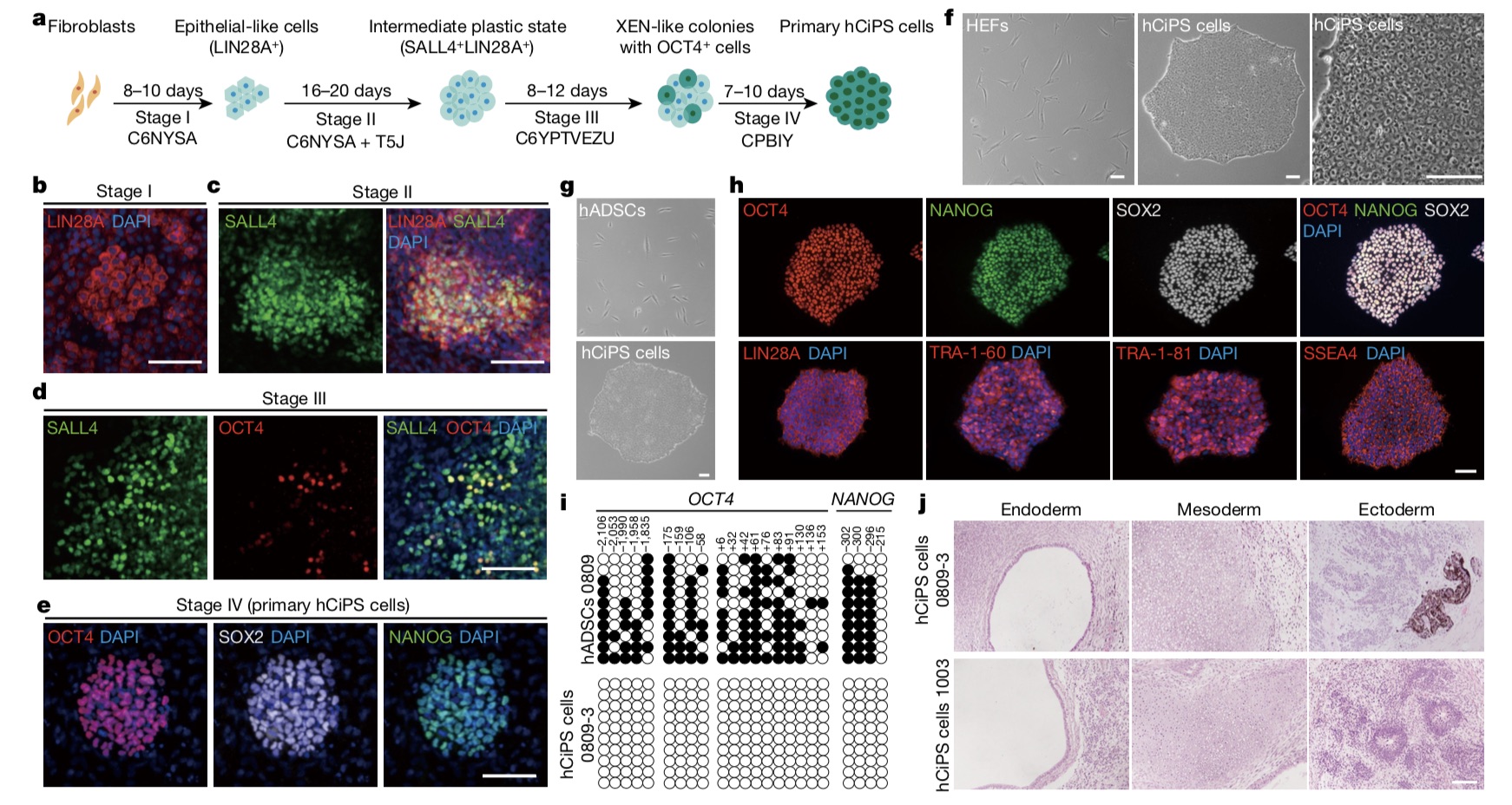
使用化學(xué)小分子實現(xiàn)人CiPS細胞的成功誘導(dǎo)。
鄧宏魁認為這是一種更為精準可控的細胞命運調(diào)控方法。化學(xué)小分子操控的方式,“把重編過程變成了像火車可以停靠一樣,它可以停在任何一個階段,也就說是一個可以精細調(diào)控的過程。”
另外,相比傳統(tǒng)方法,小分子誘導(dǎo)體細胞重編程技術(shù)作為非整合方法,規(guī)避了傳統(tǒng)轉(zhuǎn)基因操作引發(fā)的安全問題,有望成為更安全的臨床治療手段。
值得關(guān)注的是,今年的2月4日,鄧宏魁團隊和中國醫(yī)學(xué)科學(xué)院/北京協(xié)和醫(yī)學(xué)院彭小忠研究組及天津市第一中心醫(yī)院沈中陽研究組合作在《自然-醫(yī)學(xué)》(Nature Medicine)發(fā)表了一項研究,他們建立了人CiPS細胞向胰島細胞的分化制備方案,并由此獲得了干細胞來源的功能成熟的胰島細胞;進一步將其移植入非人靈長類糖尿病動物模型中,系統(tǒng)驗證了人CiPS細胞分化的胰島治療糖尿病的安全性和有效性。
鄧宏魁透露,在糖尿病猴子模型上試驗之后,目前正在積極推進臨床。“因為在猴子上的結(jié)果很好,我們還是很有信心的。”盡管目前這些初步的跡象表明,這項技術(shù)在安全性上有優(yōu)越性,他同時強調(diào),“安全性依然是最關(guān)鍵的,這個還要經(jīng)過仔細的長期的對比研究,但小分子的優(yōu)化有巨大空間。”





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯(lián)網(wǎng)新聞信息服務(wù)許可證:31120170006
增值電信業(yè)務(wù)經(jīng)營許可證:滬B2-2017116
? 2014-2025 上海東方報業(yè)有限公司




