- +1
46萬美元一針?首款國產CAR-T細胞療法獲美FDA批準
國產創新藥出海成功。
當地時間2月28日,傳奇生物科技股份有限公司(NASDAQ: LEGN,傳奇生物)在美國宣布,其自主研發的細胞治療產品西達基奧侖賽(英文商品名:CARVYKTI,簡稱Cilta-cel)獲得美國食品和藥品監督管理局(FDA)批準上市, 用于治療復發或難治性多發性骨髓瘤患者,這些患者既往接受過四種或四種以上的治療,包括蛋白酶體抑制劑、免疫調節劑和抗CD38單克隆抗體。
這是傳奇生物首款獲批上市的產品,是首款獲得FDA批準的國產CAR-T細胞療法,也是全球第二款獲批上市的 BCMA 靶向 CAR-T 療法。今年2月10日,信達生物PD-1腫瘤藥闖關FDA遇挫,而此次CAR-T療法獲批,成為中國創新藥出海注入了信心。
CAR-T療法主要是通過基因工程技術,人工改造腫瘤患者的T淋巴細胞,在體外大量培養后生成腫瘤特異性CAR-T細胞,再將其回輸入患者體內用以攻擊癌細胞,進而達到治療疾病的目標。與傳統的化療、放療、靶向等腫瘤治療方向相比,CAR-T療法讓腫瘤有了治愈的可能,更有說法稱其為“神藥”。
傳奇生物的CARVYKTI是一款具有兩種靶向B細胞成熟抗原(BCMA)單域抗體的嵌合抗原受體 (CAR) T細胞免疫療法,以一次性輸液的方式給藥,推薦劑量為每公斤體重0.5-1.0×10^6個CAR-T細胞。
此次CARVYKTI的獲批主要基于關鍵性臨床1b/2期 CARTITUDE-1研究結果。研究數據顯示,Cilta-cel在既往接受過四種或者以上治療(包括蛋白酶體抑制劑、免疫調節劑和抗CD38單克隆抗體)的復發或難治性多發性骨髓瘤患者中顯示出高達98%的總緩解率。
公開資料顯示,全球已經有7款CAR-T療法獲批,其中有兩款在中國獲批,包括復星凱特的阿基侖賽注射液和藥明巨諾的瑞基奧侖賽注射液,均于2021年獲批,因此2021年被稱為中國CAR-T療法商業化元年。傳奇生物的西達基奧侖賽在國內還處于臨床階段,于2020年8月在中國被納入“突破性治療藥物”。
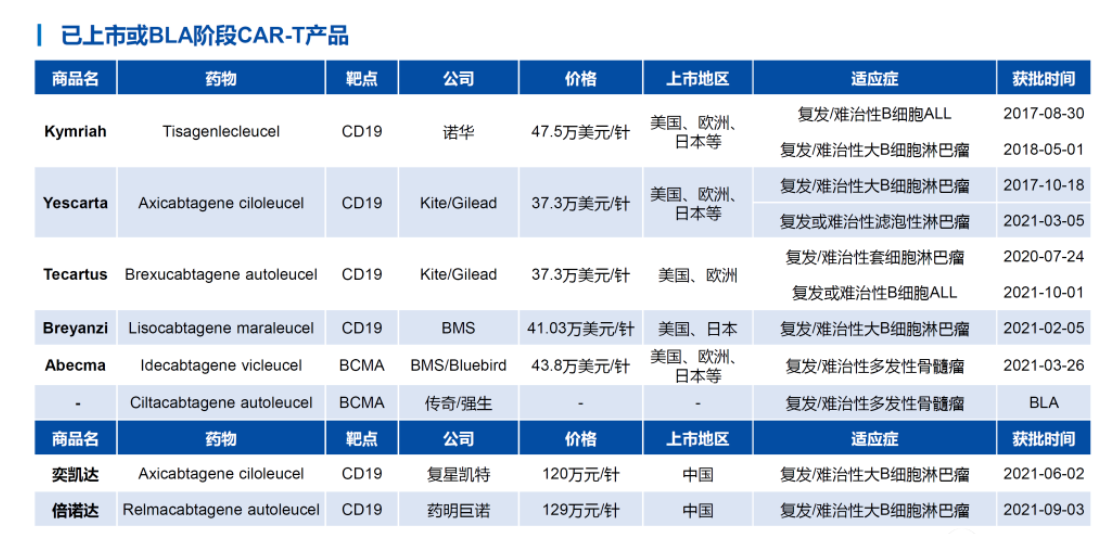
華創證券研報資料
CAR-T療法價格不菲,兩款已經在國內獲批的產品價格均達到百萬元一針。業內有消息稱,傳奇生物的西達基奧侖賽價格超過46萬美元。對于上述消息,傳奇生物向澎湃新聞記者強調,目前價格還不會公布。
如何擴大CAR-T療法的可及性,此前傳奇生物在接受澎湃新聞記者采訪時表示,降低CAR-T產品的高昂定價問題可以從兩個方向著手,一是國產化替代,二是通用型CAR-T技術發展,減少病患的治療時間的同時,還可以減輕在患病過程中的痛苦。
傳奇生物成立于2014年,是一家集腫瘤免疫細胞療法研發、臨床、生產及商業化開發于一體的跨國生物制藥公司。此外,該公司還有多款在硏CAR-T療法,用于血液瘤、實體瘤及其它疑難疾病的治療。傳奇生物美股盤后大漲超12%。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業有限公司




