- +1
輝瑞疫苗為何被推薦緊急使用?新英格蘭醫學雜志披露申請基礎
當地時間12月10日,美國食品藥品管理局(FDA)疫苗與相關生物制品專家組21名成員以17票贊成、4票反對和1票棄權的投票結果,推薦FDA給予德國BioNTech和美國輝瑞公司合作開發的mRNA新冠疫苗緊急使用授權。

也就在同一天,頂級醫學期刊《新英格蘭醫學雜志》(NEJM)在線發表了一篇論文,披露了上述BNT162b2的3期臨床試驗的中期分析結果。研究團隊稱,這一論文中的數據和試驗結果是申請緊急使用授權的基礎。但關于疫苗免疫原性和免疫應答持久性的2/3期數據的收集正在進行中,不作報道。
論文提到,中國團隊向全球公布新冠病毒基因組序列后,也就是1月10日,BNT162b2的開發工作就開始啟動。這一新型的mRNA疫苗是一種納米顆粒配方、核苷修飾RNA疫苗,能夠編碼融合前穩定、膜錨定的SARS-CoV-2全長刺突蛋白。
在這項仍在進行中的多國、安慰劑對照、觀察者盲化的關鍵有效性試驗中,研究團隊以1:1比例將≥16歲的人隨機分組,分別間隔21天接受兩劑安慰劑或BNT162b2候選疫苗接種(每劑30μg)。
這項疫苗臨床試驗的主要終點為預防COVID-19的有效性和安全性。此次發表的這篇論文報告了在初始人群中檢測到的前170個COVID-19病例,并包括中位2個月的安全性數據。
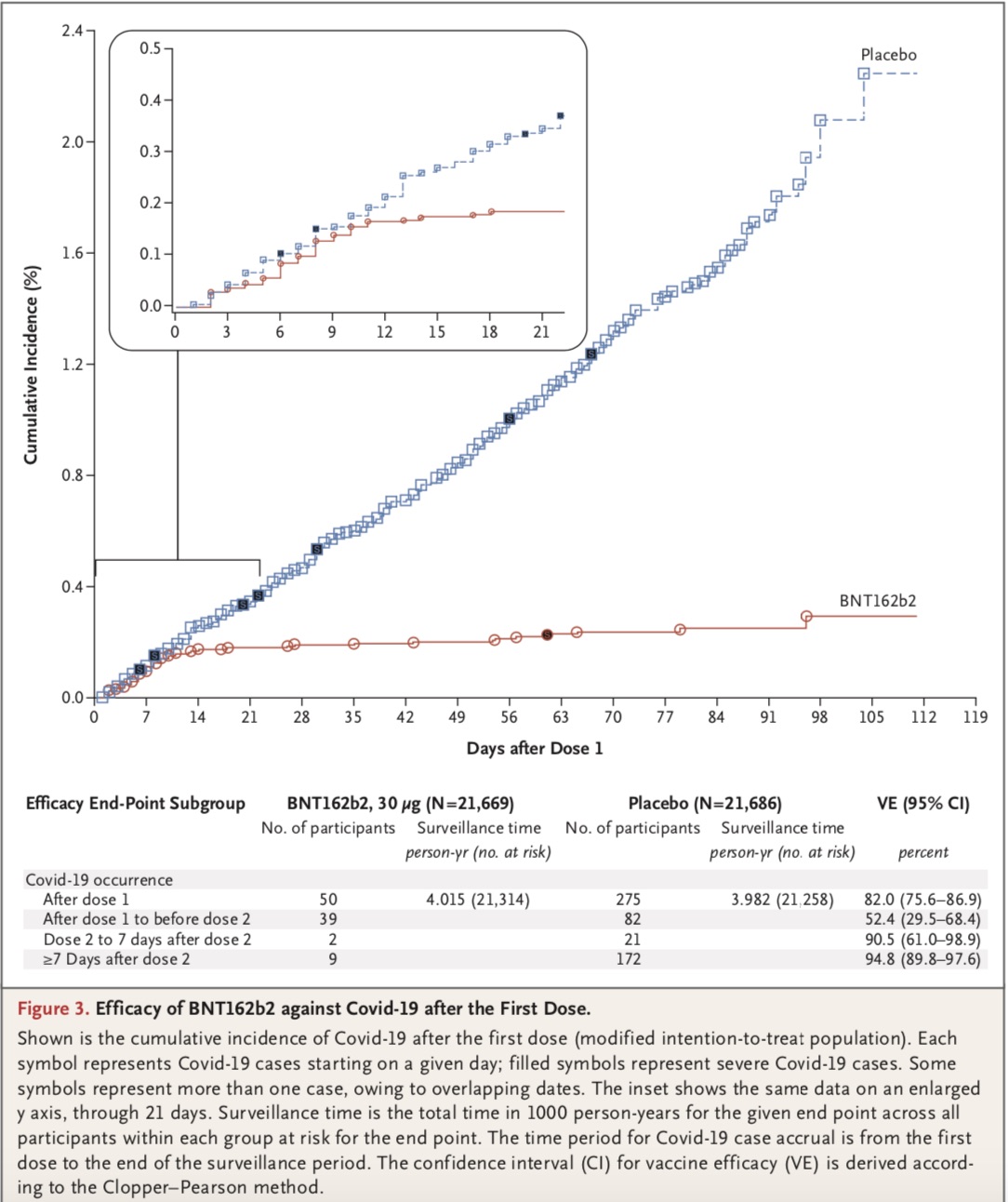
論文結論顯示,總共43548例參與者被隨機分組,其中43448例接受注射:21720例注射了BNT162b2,21728例注射了安慰劑。BNT162b2組8例參與者和安慰劑組162例參與者在第二劑注射后≥7日發病。
在預防COVID-19方面,BNT162b2的有效率為95%(95%可信區間:90.3-97.6)。在根據年齡、性別、人種、族群、基線體質指數和合并癥存在情況定義的各亞組中,均觀察到了相似的疫苗有效率(通常為90%-100%)。
在第一劑注射后發生的10例重癥COVID-19中,9例發生在安慰劑接種者中,1例發生在BNT162b2接種者中。
BNT162b2安全性特征包括短期的輕度至中度注射部位疼痛、疲勞和頭痛。論文提到,在疫苗組和安慰劑組中,嚴重不良事件發生率較低并且相似。

研究團隊認為,對于≥16歲的人群,BNT162b2兩劑接種方案預防COVID-19的有效率為95%。中位2個月期間的安全性與其他病毒疫苗相似。
研究團隊在討論中指出,這些結果表明,COVID-19可以通過免疫預防,為基于RNA的疫苗這一新方法的概念提供了證據,并證明了只要投入足夠的資源,RNA疫苗可以快速開發,BNT162b2從開發到現在僅經歷了11個月。值得注意的是,截至目前,尚未有mRNA疫苗被正式批準商業化使用。
研究團隊稱,在目前疫情仍在大流行的背景下,如果獲得批準,BNT162b2疫苗可與其他公共衛生措施一起有助于減少OVID-19全球傳播造成的健康、生命以及經濟和社會福祉的毀滅性損失。





- 報料熱線: 021-962866
- 報料郵箱: news@thepaper.cn
互聯網新聞信息服務許可證:31120170006
增值電信業務經營許可證:滬B2-2017116
? 2014-2025 上海東方報業有限公司




